
| A. | 熵减的吸热反应可能是自发反应 | |
| B. | 需要加热的化学反应,生成物的总能量一定高于反应物的总能量 | |
| C. | 使用催化剂既不会改变反应的限度又不会改变反应的焓变 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
分析 A.反应能否自发进行取决于△G=△H-T•△S,当△H-T•△S<0时反应能自发进行,催化剂可降低反应的活化能,但不能改变反应热;
B.需要加热的反应中,生成物的总能量不一定高于反应物的总能量;
C.催化剂可降低反应的活化能,但不能改变反应热;
D.结合盖斯定律计算得到所需热化学方程式和焓变.
解答 解:A.反应能否自发进行取决于焓变和熵变的综合判据,当△H-T•△S<0时反应能自发进行,熵减的吸热反应,△S<0,△H>0,△H-T•△S>0,反应不可能是自发反应,故A错误;
B.某些放热反应也需要加热,如铝热反应是放热反应,反应物能量高于生成物,反应需要加热才能发生,故B错误;
C.催化剂可降低反应的活化能,但不能改变反应热,不能使平衡发生移动,使用催化剂既不会改变反应的限度又不会改变反应的焓变,故C正确;
D.在一定条件下,已知:
①2C(s)+2O2(g)═2CO2(g)△H1
②2C(s)+O2(g)═2CO(g)△H2
依据盖斯定律①-②得到2CO(s)+O2(g)═2CO2(g)△H=△H1-△H2,反应是放热反应,△H1-△H2<0,△H1<△H2,故D错误;
故选C.
点评 本题考查反应热与焓变,题目难度不大,注意反应能否自发进行取决于焓变和熵变的综合判据,不能只根据焓变或熵变进行判断.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题

| A. | 将乙醛加入含有新制银氨溶液的试管中,于沸水浴中加热来制得银镜 | |
| B. | 称量12.5gCuSO4•5H2O,配成100mL溶液,得到0.5mol/L的CuSO4溶液 | |
| C. | 用图1装置检验实验室制得的乙烯中混有SO2和CO2 | |
| D. | 利用图2装置从氯化铁溶液中直接蒸发结晶获得氯化铁晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 任意比 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
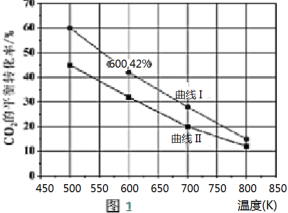 甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,二氧化碳加氢合成甲醇是合理利用二氧化碳的有效途径.由二氧化碳制备甲醇过程中可能涉及反应如下:
甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,二氧化碳加氢合成甲醇是合理利用二氧化碳的有效途径.由二氧化碳制备甲醇过程中可能涉及反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CHO (l) | B. | CH3CHO (g) | C. | CO(g) | D. | CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 试剂(或条件) | |
| A | 温度对H2O2分解反应速率的影响 | ①热水浴②冰水浴 |
| B | 用稀硫酸比较铝和铁的金属活动性 | ①铝粉 ②铁钉 |
| C | 用酸化的AgNO3溶液检验海水中Cl-能否蒸馏除去 | ①海水 ②蒸馏所得液体 |
| D | 用Na块检验乙醇分子存在不同于烃分子里的氢原子 | ①乙醇 ②煤油 |

| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) | |
| B. | 0.1 mol/L NaHCO3溶液:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) | |
| C. | 0.3mol/L和0.1mol/L的两醋酸溶液中H+离子浓度之比为3:1 | |
| D. | 25℃时,浓度均为0.1mol•L-1的CH3COOH和CH3COONa混合溶液的pH=4.75,则c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com