
| 键能 | 键能 | 键能 | |||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 |
| S=S | 255 | H-S | 339 | C-F | 427 |
| C-Cl | 330 | C-I | 218 | H-F | 565 |
| C-O | 347 | H-O | 464 |
| A. | 键能越大,物质的热稳定性越强 | |
| B. | 热化学方程式H2(g)+Cl2(g)═2HCl(g);△H=-QkJ•mol-1中,Q的值为185 | |
| C. | H-O键的键能大于H-S键的键能,所以H2O的溶沸点高于H2S的溶沸点 | |
| D. | C-Br键的键能应在218kJ•mol-1-330kJ•mol-1之间 |
分析 A.键能越大,破坏化学键吸收的能量越多;
B.根据反应热=反应物总键能-生成物总键能来计算;
C.分子晶体的熔沸点与共价键无关;
D.原子半径越小,共价键的键能越大.
解答 解:A.键能越大,破坏化学键吸收的能量越多;
B.根据反应热=反应物总键能-生成物总键能,得到:△H=436kJ/mol+330kJ/mol-432×2=-185kJ/mol,则Q的值为185,故B正确;
C.分子晶体的熔沸点与共价键无关,与分子间作用力和氢键有关,H2O的溶沸点高于H2S的溶沸点,是因为水分子之间存在氢键,故C错误;
D.原子半径越小,共价键的键能越大,原子半径:I>Br>Cl,所以C-Br键的键能应在218kJ•mol-1-330kJ•mol-1之间,故D正确.
故选C.
点评 本题考查了反应热的计算、化学键与反应热、物质稳定性的关系,题目难度不大,本题注意从化学反应的反应热和焓变的关系为解答该题的关键.


科目:高中化学 来源: 题型:多选题
| A. | R在化合物中显+1价 | |
| B. | 最高价氧化物对应水化物的碱性:X>R | |
| C. | 原子半径X>Y>Z | |
| D. | 简单气态氢化物的热稳定性:Y<W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发酵粉就是NaHCO3,使用它可使生产的食品疏松可口 | |
| B. | 放置较久的红薯比新挖出土的甜,可能与葡萄糖的水解有关 | |
| C. | 燃煤中添加适量的CaO,有利于降低酸雨形成的概率 | |
| D. | 用液溴来吸收香蕉产生的乙烯,达到保鲜的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
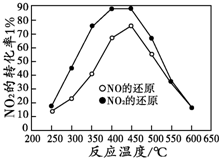 汽车排气中的CO、NOX已经成为大气的主要污染物,使用稀土等催化剂能将CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染.
汽车排气中的CO、NOX已经成为大气的主要污染物,使用稀土等催化剂能将CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
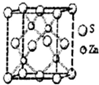 化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑,请根据你所学知识回答:
化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑,请根据你所学知识回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 序号 | 物质 | 被选出的 |
| (1) | O2、H2、C、N2 | C |
| (2) | Fe、Na、Al、Si | Si |
| (3) | NO、CO2、SO2、Fe3O4 | Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
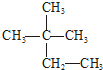 ③白磷 ④氯气
③白磷 ④氯气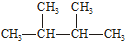 ⑥${\;}_{17}^{37}$Cl ⑦${\;}_{17}^{35}$Cl ⑧红磷
⑥${\;}_{17}^{37}$Cl ⑦${\;}_{17}^{35}$Cl ⑧红磷 ,含四原子核10电子的阳离子离子符号H3O+,含四原子核18电子的共价化合物化学式H2O2.
,含四原子核10电子的阳离子离子符号H3O+,含四原子核18电子的共价化合物化学式H2O2.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com