



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.原电池工作时,阴离子移向正极 |
| B.铁片表面镀锌,铁片接电源负极 |
| C.用Cu作电极电解H2O,阳极反应为:4OH--4e-===2H2O+O2↑ |
| D.向AgCl饱和溶液中加入NaCl固体,c (Cl-)增大,Ksp增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
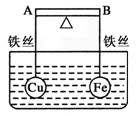
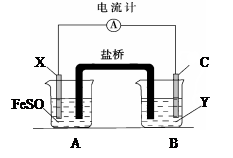
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
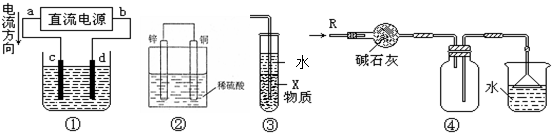
| A.若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
| B.装置②是原电池,能将化学能转化为电能,锌电极发生氧化反应 |
| C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
| D.装置④可用于收集氨气,并吸收多余的氨气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2PbSO4+2H2O
2PbSO4+2H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铁表面镀锌,锌作阳极 |
| B.船底镶嵌锌块,锌作正极,以防船体被腐蚀 |
| C.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-=4OH- |
| D.工业上电解饱和食盐水的 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.放电时,负极质量增加 |
| B.充电时,应将外接直流电源的正极与蓄电池的铅电极相接 |
C.放电时,正极反应为: |
| D.铅蓄电池做电源电解Na2SO4溶液时,当有lmolO2产生时,消耗4molH2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 VO2++2H++V2+。下列叙述正确的是 ( )
VO2++2H++V2+。下列叙述正确的是 ( )| A.充电时阳极附近溶液的酸性减弱 |
| B.充电时阳极反应式为:VO2++2H++e-=VO2++H2O |
| C.放电过程中电解质溶液中阳离子移向负极 |
| D.放电时每转移1mol电子,负极有1mol V2+被氧化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
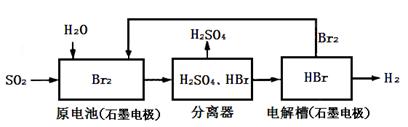
| A.电解槽中也可以用铁电极代替石墨作为阳极 |
| B.原电池中负极的电极反应为:SO2+2H2O+4e-=SO42-+4H+ |
| C.该工艺流程用总反应的化学方程式表示为:SO2+Br2+2H2O=2HBr+H2SO4 |
| D.该生产工艺的优点Br2被循环利用,原电池产生的电能可充分利用,还能获得清洁能源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com