
常温下,向O.1 mol/L的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中不正确的是 ( )
A.溶液的pH:a<b<c<d
B.溶液的导电能力:a>b>d>c
C.a、b溶液呈酸性
D.c、d溶液呈碱性

科目:高中化学 来源: 题型:
 如图所示为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
如图所示为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:



 或
或
 或
或

 4Al+3O2↑
4Al+3O2↑ 4Al+3O2↑
4Al+3O2↑查看答案和解析>>
科目:高中化学 来源: 题型:


| 实验 | 主要实验步骤及实验现象 |
| 1 | 向Y溶液中加入稀H2SO4,产生淡黄色沉淀和无色有刺激性气味的气体,该气体能使品红溶液退色. |
| 2 | 向M溶液中连续滴加Z溶液,初有白色沉淀,后沉淀溶解. |
| 3 | 向M稀溶液中滴加硝酸酸化的硝酸银溶液,产生白色沉淀. |


| 水解 |
| 水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||
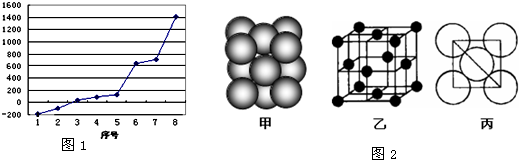


| ||
| 8NAd3 |
| ||
| 8NAd3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com