
| A. | 浓盐酸 | B. | 浓硝酸 | C. | 浓硫酸 | D. | 氢氧化钠溶液 |
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:选择题
 太原市自2016年11月1日零时起,将汽车用油全部更换为”国V标准”车用燃料,进而 改善太原市空气质量.下列物质中,不会造成空气污染的是( )
太原市自2016年11月1日零时起,将汽车用油全部更换为”国V标准”车用燃料,进而 改善太原市空气质量.下列物质中,不会造成空气污染的是( )| A. | NO | B. | SO2 | C. | CO2 | D. | 粉尘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向逆反应方向移动 | B. | B的质量分数增加 | ||
| C. | a>b | D. | A的转化率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
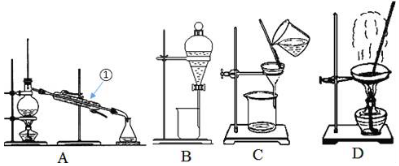
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
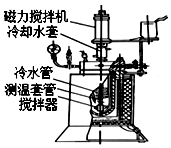 实验室用间二硝基苯通过催化加氢制备间硝基苯胺的实验步骤如下:
实验室用间二硝基苯通过催化加氢制备间硝基苯胺的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有Fe2+和Cu2+ | B. | 一定有Fe2+,Cu2+,可能有Fe3+ | ||
| C. | 一定有Fe2+,可能有Cu2+ | D. | 只有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=6的NaHSO4溶液:c(Na+)+c(H+)=2c(SO42-)+c(OH-) | |
| B. | 0.1 mol/L NaHCO3溶液加水稀释后,c(H+)与c(OH-)的乘积不变 | |
| C. | pH相同的①CH3COONa、②NaClO两种溶液的c(Na+):①<② | |
| D. | 反应2Mg(s)+CO2(g)═C(s)+2MgO(s)能自发进行,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2016年12月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因.
2016年12月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol甲基(-CH3)所含电子数为9NA | |
| B. | 标准状况下,22.4 L己烷中含氢原子数目为14NA | |
| C. | 标准状况下,B2H6和C2H4的混合气体22.4 L,所含的电子数约为16NA | |
| D. | 26 g C2H2和苯蒸气的混合气体中所含的C原子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com