
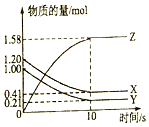
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:分析 (1)由图象可以看出,反应中x、Y的物质的量减少,应为反应物,z的物质的量增多,应为生成物,根据化学反应中各物质的物质的量变化量与化学计量数之比呈正比书写化学方程式;
(2)根据v=$\frac{△c}{△t}$=$\frac{\frac{△n}{V}}{△t}$计算化学反应速率;
(3)图象分析计算减少的物质的量,c=$\frac{n}{V}$计算得到浓度.
解答 解:(1)由图象可以看出X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,
化学反应中各物质的物质的量变化量与化学计量数之比呈正比,
则有Y:X:Z=(1.20mol-0.41mol):(1.0mol-0.21mol):(1.58-0)mol=1:1:2,则反应的化学方程式为X+Y?2Z,
故答案为:X+Y?2Z;
(2)反应开始到10s,用Z表示的反应速率为:v=$\frac{△c}{△t}$=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{1.58mol}{2L}}{10s}$=0.079mol/(L•s),
故答案为:0.079mol/(L•s);
(3)图象分析计算减少的物质的量,反应开始到10s,X的物质的量浓度减少了c=$\frac{n}{V}$=$\frac{1.2mol-0.41mol}{2L}$=0.395mol/L;
故答案为:0.395mol/L.
点评 本题考查物质的量随时间的变化曲线,以及化学平衡的计算,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意把握化学方程式的判断方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 33% | C. | 50% | D. | 89% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液洗气时发生反应的离子方程式为:2OH-+Cl2=Cl-+ClO-+H2O | |
| B. | 根据实验可以得出中性条件下,氧化性Cl2>O2 | |
| C. | 根据实验可以得出反应物的浓度和溶液的pH会影响物质的氧化性 | |
| D. | 当电路中通过2mol电子时,阳极可收集到标准状况下气体体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)氮是地球上含量丰富的一种元素,氮及其化合物在工、农业生产和生活中有着重要作用.
(1)氮是地球上含量丰富的一种元素,氮及其化合物在工、农业生产和生活中有着重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随核电荷数的增加 X-的半径递增,还原性递减(用X表示卤素原子) | |
| B. | 氢化物的稳定性随核电荷数的增加逐渐增强 | |
| C. | 单质与水反应均可表示为 X2+H2O═HX+HXO(用X表示卤素原子) | |
| D. | 单质的颜色随核电荷数的增加逐渐加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衝所需时间/min | ||
| CO | H2O | CO2 | ||||
| 1 | 500 | 8 | 4 | 3.2 | 4 | |
| 2 | 700 | 4 | 2 | 0.8 | 3 | |
| 3 | 700 | 4 | 2 | 0.8 | 1 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验操作 | 实验现象 | 解释 |
| A | 将铜粉加入1.0mol/LFe(SO4)3溶液中 | 溶液变蓝 | 金属铁比铜活泼 |
| B | 将在Na2SiO3稀溶液中浸泡过的小木条立即置于酒精灯外焰 | 小木条不易燃烧 | Na2SiO3溶液有阻燃的作用 |
| C | 向NaBr溶液中滴加氯水 | 溶液颜色变成橙黄色 | 氯水中含有HClO |
| D | 将一小块金属钠放置于坩埚里加热 | 钠块先融化成小球,再燃烧 | 钠的熔点比钠的着火点低 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
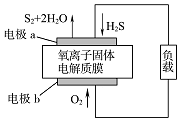 新华网报道:我国固体氧化物燃料电池技术研发取得新突破.科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示.下列说法正确的是( )
新华网报道:我国固体氧化物燃料电池技术研发取得新突破.科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示.下列说法正确的是( )| A. | 电极b为电池的负极 | |
| B. | 电路中每流过4 mol电子,正极消耗44.8 L H2S | |
| C. | 电极b上的电极反应为:O2+4e-+4H+═2H2O | |
| D. | 电极a上的电极反应为:2H2S+2O2--4e-═S2+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com