
【题目】分别用一个化学方程式解释下列问题。
(1)甲烷与氯气的混合物在漫射光下—段时间,出现白雾:__________________。
(2)溴水中通入乙烯,溴水颜色退去:_________________________。
(3)工业上通过乙烯水化获得乙醇:______________________________。
【答案】CH4+ Cl2![]() CH3Cl+HCl CH2=CH2+Br2
CH3Cl+HCl CH2=CH2+Br2![]() CH2BrCH2Br CH2=CH2+H2O
CH2BrCH2Br CH2=CH2+H2O![]() CH3CH2OH
CH3CH2OH
【解析】
(1)CH4与Cl2在光照条件下生成氯代甲烷(CH3Cl、CH2Cl2等)和HCl,HCl在空气中可形成白雾;
(2)CH2=CH2与Br2发生加成反应生成CH2BrCH2Br,使溴水退色;
(3)CH2=CH2与水发生加成反应生成 CH3CH2OH。
(1)CH4与Cl2在光照条件下生成氯代甲烷(CH3Cl、CH2Cl2等)和HCl,HCl在空气中可形成白雾,发生的化学反应方程式为:CH4+ Cl2![]() CH3Cl+HCl;
CH3Cl+HCl;
(2)CH2=CH2与Br2发生加成反应生成CH2BrCH2Br,使溴水退色,发生的化学反应方程式为:CH2=CH2+Br2![]() CH2BrCH2Br;
CH2BrCH2Br;
(3)CH2=CH2与水发生加成反应生成CH3CH2OH,发生的化学反应方程式为:CH2=CH2+H2O![]() CH3CH2OH。
CH3CH2OH。


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】Cl2O为国际公认的高效安全灭菌消毒剂之一,实验室可利用氯气和空气(氯气与空气体积比为1∶3,空气不参与反应)的混合气与含水8%的碳酸钠反应制备,并用水吸收Cl2O制备次氯酸溶液,所用实验装置和Cl2O的性质如下:

颜色 | 棕黄色 |
状态 | 气体 |
气味 | 强刺激性 |
熔点 | -116 ℃ |
沸点 | 3.8 ℃ |
水溶性 | 极易溶于水,与水反应生成次氯酸 |
热稳定性 | 42 ℃以上分解为Cl2和O2 |
(1)仪器a的名称为________,所盛放的药品是________。
(2)写出装置A中发生反应的离子方程式:_______________。
(3)装置C的主要作用是___________。
(4)装置D、E中都用到多孔球泡,其作用是____________。
(5)写出装置D中Cl2与过量碳酸钠反应生成Cl2O的化学方程式:________。
(6)装置E采用棕色圆底烧瓶的原因是____________。
(7)制备Cl2O装置中存在缺陷,请提出改进措施:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 表示阿伏加德罗常数,下列说法正确的是
表示阿伏加德罗常数,下列说法正确的是![]()
A.标准状况下,等体积的水和![]() ,含有的氧原子数目为1:2
,含有的氧原子数目为1:2
B.含有![]() 个阴离子的
个阴离子的![]() 与足量水反应,转移电子数为
与足量水反应,转移电子数为![]()
C.向含有![]() 的溶液中通入适量氯气,当有
的溶液中通入适量氯气,当有![]() 个
个![]() 被氧化时,共转移电子数为
被氧化时,共转移电子数为![]()
D.一个NO分子质量为![]() ,一个
,一个![]() 分子质量是
分子质量是![]() ,则
,则![]() 个
个![]() 的质量为
的质量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是![]()
![]()
选项 | 实验操作 | 实验现象 | 结论 |
A | 向足量含KSCN的 | 溶液变黄 | 还原性:Fe2+>Br- |
B | 向2mL浓度为 | 开始出现白色沉淀,后出现黄色沉淀 |
|
C | 取等质量的Al和Fe,分别与足量的稀硫酸反应 | Al产生的氢气多 | 金属性: |
D | 向苯酚浊液中滴加饱和 | 浊液变澄清 | 酸性:苯酚 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨的反应为:3H2+ N2![]() 2NH3,其反应的速率可分别表示为v(H2)、v(N2)、v(NH3)(单位为mol·L-1·s-1),则下列关系正确的是
2NH3,其反应的速率可分别表示为v(H2)、v(N2)、v(NH3)(单位为mol·L-1·s-1),则下列关系正确的是
A.v(H2)=v(N2)= v(NH3)B.v(H2)=3 v(N2)
C.v(N2)=2 v(NH3)D.v(NH3)=3/2v(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,能使电离平衡H2O![]() H++OH-,向右移动且溶液呈酸性的是 ( )
H++OH-,向右移动且溶液呈酸性的是 ( )
A.向水中加入NaHSO4溶液
B.向水中加入Al2(SO4)3固体
C.向水中加入Na2CO3溶液
D.将水加热到100℃,使pH=6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在 5 L 的容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题。

(1)反应进行至_________min 时达到平衡状态,此时 Y 的平均反应速率是________mol/ (L·min)。
(2)分析有关数据,写出 X、Y、Z 的反应方程式_________________;
(3)对于一个未知反应,影响反应速率的因素很多,请写出可能影响化学反应速率的三个因素:______________,____________,__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)“84”消毒液是一种常用的消毒剂,其有效成分是______(填化学式)。某学生用石墨作电极电解饱和氯化钠溶液,制作了一种家用环保型消毒液发生器,如图所示。电极c处发生反应的离子方程式依次为:2H2O+2e-=H2↑+2OH-;_____。
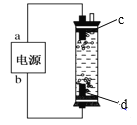
(2)“84”消毒液工业品中常含有1.5%~3%的NaOH,其目的一是使平衡_____(写出离子方程式)向逆方向移动;二是吸收空气中的_____(填化学式)防止消毒液失效。
(3)消毒液中氯元素的存在形态与溶液pH的关系如下:
溶液pH | >9 | 5~6 | 4~5 | 2~3 | <2 |
主要成分 | NaClO | HClO与NaClO(少量) | HClO与Cl2(少量) | HClO与Cl2 | Cl2 |
请你写出pH降低时产生氯气的离子方程式:_____。
(4)某同学猜测“84消毒液”(以下简称“84”)可以“漂白”米醋,进行了实验1和实验2:
编号 | 实验操作 | 实验现象 |
实验1 |
滴加2滴米醋,5滴管“84” | 溶液无色,闻到刺激性气味 |
实验2 |
滴加2滴米醋,5滴管蒸馏水 | 溶液为浅棕色,无刺激性气味 |
实验2的目的是:①______;②______。
为进一步研究“84”与米醋的反应,该同学又进行了以下实验:
编号 | 实验操作 | 实验现象 |
实验3 |
逐滴加入“84”,10滴米醋 | “84”滴入后迅速产生刺激性气味的气体;滴加至5滴时,溶液开始褪色;滴加至21滴时,褪为淡黄色;继续滴加不再出现明显褪色。 |
实验4 |
逐滴加入米醋,21滴“84” | 滴入米醋后立即褪色;当米醋滴加至10滴时,溶液较实验3颜色更浅;当米醋加至17滴时,与实验3中溶液最终颜色相同。 |
请你结合上述实验和相关资料,分析实验3与实验4现象的差异:______。
(5)某工厂使用次氯酸钠漂白棉布,该工厂对生产条件进行了研究,结果如图所示:
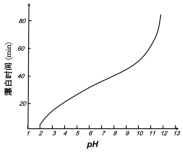
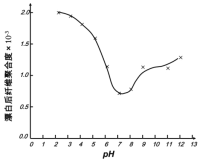
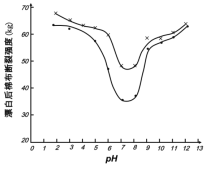
查阅资料得知:次氯酸钠对纤维素的破坏分为两个阶段进行。第一阶段:纤维素纤维的羟基与次氯酸作用生成次氯酸酯;第二阶段:生成的次氯酸酯在OH-离子作用下,失去一分子氯化氢,并转变为醛或酮,直接影响纤维素化学键的稳定性。
①当溶液pH=7时,纤维聚合度最低,纤维损伤最严重的原因是:_____。
②综合考虑,生产过程中pH最好选择_____,理由是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验方案能达到实验目的的是

A.用图①的装置制取并收集干燥的NH3B.用图②的装置验证乙炔的还原性
C.用图③的装置制取溴苯D.用图④的装置分离CO和CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com