
| A. | 第四周期IVA族 | B. | 第五周期IVA族 | C. | 第四周期VA族 | D. | 第五周期VA族 |
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:选择题
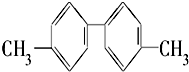
| A. | 分子中至少有4个碳原子处于同一直线上 | |
| B. | 该烃苯环上的一氯代物有4种 | |
| C. | 分子中至少有10个碳原子处于同一平面上 | |
| D. | 该烃是苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(C)•{c}^{2}(D)}{c(A)•c(B)}$ | |
| B. | 若向平衡体系中加入少量生成物C,则正、逆反应速率均增大 | |
| C. | 增大该体系的压强,A的转化率增大 | |
| D. | 该条件下B的平衡转化率是40% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3 mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
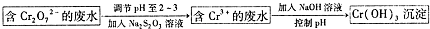
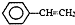 ),聚苯乙烯的化学式为
),聚苯乙烯的化学式为
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | O═O | O-H |
| 断开1mol化学键所需的能量/kJ | 436 | x | 463 |
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO (g)和2mol H2(g) | 1mol CH3OH(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出54kJ | 吸收a kJ |
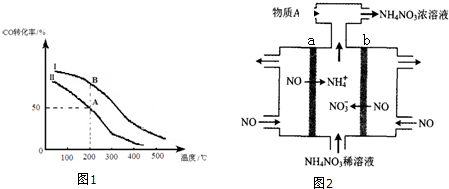
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com