
| A. | 标准状况下,22.4LC2H2、C2H6的混合气体与22.4LC2H4中所含原子总数均为6NA | |
| B. | 常温下,1L PH=14的NaOH溶液中由水电离出的OH-个数为NA | |
| C. | 标准状况下,11.2L的12C16O和14N2的混合气体中所含中子数和原子数的差值为6NA | |
| D. | 将200mL0.1mol•L-1FeCl3溶液制成胶体,所得Fe(OH)3胶体粒子数为0.02NA |
分析 A.未确定乙炔与乙烷比例,无法计算所含原子个数;
B.pH=14的NaOH溶液中氢离子的浓度为:10-14mol/L,而水电离出氢离子浓度等于氢氧根离子浓度,所以1L溶液中水电离出的OH-个数为10-14NA;
C.标准状况下,11.2L的气体的物质的量$\frac{11.2L}{22.4L/mol}$=0.5mol,原子的物质的量为:0.5mol×2=1mol,中子的物质的量为:0.5×14=7mol;
D.胶体微粒是多个氢氧化铁的集合体.
解答 解:A.乙炔与乙烷含有原子个数不同,二者比例不确定,无法计算含有原子个数,故A错误;
B.pH=14的NaOH溶液中氢离子的浓度为:10-14mol/L,而水电离出氢离子浓度等于氢氧根离子浓度,所以1L溶液中水电离出的OH-个数为10-14NA,故B错误;
C.标准状况下,11.2L的气体的物质的量$\frac{11.2L}{22.4L/mol}$=0.5mol,原子的物质的量为:0.5mol×2=1mol,中子的物质的量为:0.5×14=7mol,所以标准状况下,11.2L的12C16O和14N2混合气体所含中子数和原子数的差值为6NA,故C正确;
D.将200mL0.1mol•L-1FeCl3溶液制成胶体,所得Fe(OH)3胶体粒子数小于0.02NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的应用,主要考查质量换算物质的量计算微粒数,明确物质的结构组成,熟悉以物质的量为核心计算公式是解题关键,题目难度不大.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 称取2.0gNaOH固体 | 先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
| B | 配制MgCl2、AlCl3溶液中分别通入氨气 | 比较镁、铝的金属性强强弱 |
| C | 检验溶液中是否含有NH4+ | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 |
| D | 向NaBr溶液中滴入少量的氯水和CCl2,振荡、静置,溶液下层呈橙红色 | Cl-的还原性强于Br- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
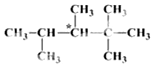 人们将有机物中连有四个不同原子(或原子团)的碳原子称为手性碳原子,如图所示烷烃X中含有一个手性碳原子(用*标记).回答下列问题:
人们将有机物中连有四个不同原子(或原子团)的碳原子称为手性碳原子,如图所示烷烃X中含有一个手性碳原子(用*标记).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,q能使品红溶液褪色.上述的转化关系如图所示.下列说法中不正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,q能使品红溶液褪色.上述的转化关系如图所示.下列说法中不正确的是( )| A. | 原子半径:Y<X<Z | |
| B. | 简单氢化物沸点:X<Y<Z | |
| C. | m与q、n与s均不能共存 | |
| D. | W、X、Y、Z四种元素可组合成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
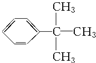 ;乙能被高锰酸钾酸性溶液氧化为分子式C8H6O4的羧酸,则乙可能的结构有9种.
;乙能被高锰酸钾酸性溶液氧化为分子式C8H6O4的羧酸,则乙可能的结构有9种. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示.试回答:
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,滴加几滴KSCN溶液,振荡 | 溶液呈血红色 | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,滴加几滴K3[Fe(CN)6]溶液,振荡 | 产生蓝色沉淀 | 存在Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com