
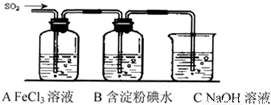
某兴趣小组挤究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:

(1)SO2气体还原Fe3+反应的产物是_____________、_____________(填离子符号)。
(2)下列实验方案可以用于在实验室制取所需SO2的是____。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是_____________。
(4)如果有280 mL SO2气体(已折算为标态)进入C装置中,则C中50 mL NaOH溶液的浓度至少为_____________mol/L才能达到目的。
(5)在上述装置中通入过量的SO2为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是____,原因是_______________________________________。
(6)能表明I-的还原性弱于SO2的现象是_________________________________________,写出有关离子方程式:_______________________________________。
(本题共12分)(1)Fe2+、SO42-;(2分) (2)BD(2分)
(3)除去多余的SO2,防止污染空气(2分)。 (4)0.25mol/L(2分)
(5)①;SO2、Fe2+都能使酸性高锰酸钾褪色(2分)
(6)B中蓝色褪去;I2+SO2+2H2O→4H++2I- +SO42-(2分)
【解析】
试题分析:(1)铁离子具有氧化性,SO2具有还原性,二者发生氧化还原反应,反应的方程式是2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,所以SO2气体还原Fe3+反应的产物是Fe2+、SO42-。
(2)A、硝酸具有强氧化性,把亚硫酸钠氧化成硫酸钠,得不到二氧化硫,故A错;B、浓硫酸虽具有强氧化性性,但不能氧化亚硫酸钠,故B正确;C、固体硫在纯氧中燃烧,操作以及氧气的用量不容易控制,故C错;D、Cu+2H2SO4(浓) 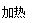 CuSO4+SO2↑+2H2O,故D正确答案选BD。
CuSO4+SO2↑+2H2O,故D正确答案选BD。
(3)SO2是大气污染物,直接排放容易造成环境污染,所以需要尾气处理。由于二氧化硫是酸性氧化物能和碱反应生成盐和水,所以可用碱液处理二氧化硫,所以重装C的作用是除去多余的SO2,防止污染空气。
(4)SO2的物质的量是0.28L÷22.4L/mol=0.0125mol,和氢氧化钠溶液反应生成亚硫酸氢钠时消耗的氢氧化钠最少,所以至少需要氢氧化钠的物质的量是0.0125mol,其浓度是0.0125mol÷0.05L=0.25mol/L。
(5)因为SO2、Fe2+均具有还原性,二者都能使酸性高锰酸钾褪色,所以方案①是错误的。
(6)二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,有关反应的方程式是I2+SO2+2H2O→4H++2I- +SO42-。在反应中碘是氧化剂,二氧化硫是还原剂,还原剂的还原性大于还原产物的还原性,所以能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色。
考点:考查SO2的制备、性质检验;氧化还原反应的有关判断以及实验方案设计和评价等


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市青浦区高考一模化学试卷(解析版) 题型:填空题
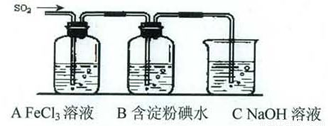
某兴趣小组挤究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
(1)SO2气体还原Fe3+反应的产物是_____________、_____________(填离子符号)。
(2)下列实验方案可以用于在实验室制取所需SO2的是____。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是_____________。
(4)如果有280 mL SO2气体(已折算为标态)进入C装置中,则C中,50 mL NaOH溶液的浓度至少为_____________mol/L才能达到目的。
(5)在上述装置中通入过量的SO2为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案@:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是____,原因是_______________________________________。
(6)能表明I-的还原性弱于SO2的现象是_____________________________________,写出有关离子方程式:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市青浦区高三(上)期末暨高考化学一模试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com