
| A. | Cu、Fe3+、Fe | B. | Fe2+、Fe3+、Fe | C. | Cu、Cu2+、Fe | D. | Cu、Fe2+、Fe |
分析 金属的还原性为:Fe>Cu,相同条件下,铁优于铜先参加反应;离子的氧化性为:Fe3+>Cu2+>Fe2+,相同条件下,铁离子先被还原,其次是铜离子;根据Fe有剩余,金属铜不会参加反应,铁离子、铜离子不会存在进行判断.
解答 解:由于铁粉有剩余,金属的还原性为:Fe>Cu,所以金属铜不会参加反应,容器中一定存在铜;能够与铁粉反应有铁离子和铜离子,所以铜离子和铁离子不会存在,与铁粉反应后生成了金属铜和亚铁离子,所以容器中一定存在亚铁离子,即反应后容器中一定存在:Cu、Fe、Fe2+,
故选D.
点评 本题考查了离子反应发生条件及离子氧化性、还原性强弱比较,题目难度不大,完成此题,可以依据金属活动性顺序及其意义来完成.


科目:高中化学 来源: 题型:选择题
| A. | 使用溴水或酸性KMnO4溶液都可鉴别乙烯和甲烷 | |
| B. | 在加热或加入重金属盐的情况下,蛋白质都可发生变性 | |
| C. | 液化石油气和天然气的主要成分都是甲烷 | |
| D. | 淀粉水解的最终产物是葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NaOH 溶液体积/mL | 40.00 | 40.00 | 40.00 |
| 样品质量/g | 7.75 | 15.50 | 23.25 |
| 氨气质量/g | 1.87 | 1.87 | 1.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
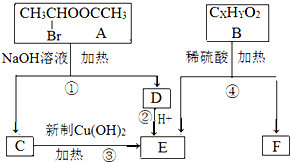 六种有机物之间的转化关系如图.已知:一个碳原子上连有两个羟基的结构极不稳定,易发生变化:R-CH(OH)2→RCHO+H2O
六种有机物之间的转化关系如图.已知:一个碳原子上连有两个羟基的结构极不稳定,易发生变化:R-CH(OH)2→RCHO+H2O
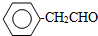 或
或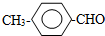 或(邻位、间位).
或(邻位、间位).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,故溶液pH不变 | |
| B. | 电解稀氢氧化钠溶液要消耗OH-,故溶液pH减小 | |
| C. | 电解硫酸钠溶液,在阴极上发生反应:4OH--4e-═2H2O+O2↑ | |
| D. | 电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com