
| 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 纯盐酸 | 淀粉溶液 | 硫酸 | 液氨 |
| B | 漂粉精 | 水玻璃 | 氧化铝 | 二氧化硫 |
| C | 胆矾 | 氢氧化铁胶体 | 碳酸钠 | 乙醇 |
| D | 水银 | 澄清石灰水 | 氯化铜 | 铁 |
| A. | A | B. | B | C. | C | D. | D |
分析 纯净物是由一种物质组成的物质;
混合物是由多种物质组成的物质;
电解质是在水溶液中或熔融状态下能导电的化合物;
非电解质是在水溶液和熔融状态下都不导电的化合物,据此回答判断.
解答 解:A.盐酸为氯化氢的水溶液,属于混合物,故A错误;
B.漂白精是2Ca(OH)2+2Cl2=CaCl2+H2O+Ca(ClO)2的产物,成分为氯化钙和次氯酸钙的混合物,故B错误;
C.胆矾是硫酸铜晶体为一种物质组成的纯净物,氢氧化铁胶体是以氢氧化铁分散到水中形成的分散系属于混合物,碳酸钠是钠离子和碳酸根离子构成的盐属于电解质,乙醇硫不能电离出离子属于非电解,故C正确;
D.铁为金属单质,不属于非电解,故D错误;
故选C.
点评 本题考查了纯净物、混合物、电解质、非电解质概念的应用判断,熟悉物质的组成,理解概念的含义是解题关键,题目较简单.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 臭氧能用于杀菌消毒 | 臭氧的还原性使细菌的蛋白质变性 |
| B | 铁能用于治疗缺铁性贫血 | 铁能与盐酸生成三氯化铁 |
| C | 过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| D | 用浸有酸性高锰酸钾的硅藻土作水果保鲜剂 | 高锰酸钾能氧化水果释放的催熟剂乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
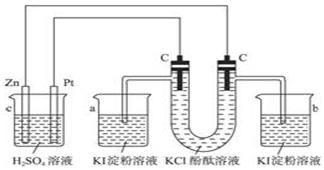
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物AB2不可能是离子化合物 | |
| B. | 化合物AB2的晶体可能是分子晶体、离子晶体或原子晶体 | |
| C. | 化合物AB2的熔点不可能很高 | |
| D. | 化合物AB2的空间立体结构不可能是V形结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 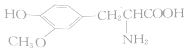 与 与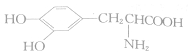 互为同系物 互为同系物 | |
| B. | CH3CH=CHCH3分子中所有原子在同一平面上 | |
| C. | 按系统命名法,化合物 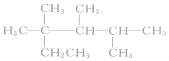 的名称是2,3,4-三甲基-2-乙基戊烷 的名称是2,3,4-三甲基-2-乙基戊烷 | |
| D. | 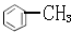 的一溴代物和 的一溴代物和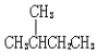 的一溴代物都有4种(不考虑立体结构) 的一溴代物都有4种(不考虑立体结构) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
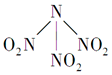 科学家最近研制出有望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )
科学家最近研制出有望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )| A. | 分子中N、O间形成的共价键是非极性键 | |
| B. | 分子中4个氮原子共平面 | |
| C. | 该分子中的中心氮原子还有一对孤电子对 | |
| D. | 15.2 g该物质含有6.02×1022个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作氧化剂 | |
| B. | CuH在氯气中燃烧的化学反应方程式为2CuH+3Cl2 $\frac{\underline{\;点燃\;}}{\;}$2CuCl2+2HCl | |
| C. | CuH溶解在稀盐酸中生成的气体是氯气 | |
| D. | 如果选项C反应中生成了标准状况下22.4 L的气体,则转移电子3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
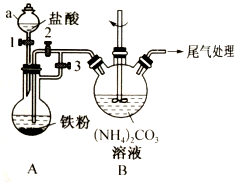 乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.以下是一种制备乳酸亚铁的实验方法.
乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.以下是一种制备乳酸亚铁的实验方法.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com