
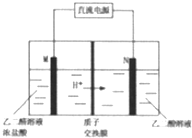
 乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图所示.该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.下列说法不正确的是( )
乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图所示.该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.下列说法不正确的是( )| A. | N电极上的电极反应式:HOOC-COOH+2e-+2H+═HOOC-CH0+H2O | |
| B. | 若有2molH+通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为1mol | |
| C. | M电极上的电极反应式为:2Cl--2e-═Cl2↑ | |
| D. | 乙二醛与M电极的产物反应生成乙醛酸的化学方程式:Cl2+OHC-CHO+H2O═HOOC-CHO+2HCl |
分析 A、N电极上HOOC-COOH得电子生成HOOC-CHO;
B、2mol H+通过质子交换膜,则电池中转移2mol电子,根据电极方程式计算;
C、根据质子的移动方向,确定M电极是阳极,阳极上发生失电子的氧化反应;
D、氯气具有氧化性,能将醛基氧化为羧基,据此书写方程式即可.
解答 解:A、N电极上HOOC-COOH得电子生成HOOC-CHO,则电极反应式为HOOC-COOH+2e-+2H+═HOOC-CHO+H2O,故A正确;
B、2mol H+通过质子交换膜,则电池中转移2mol电子,根据电极方程式HOOC-COOH+2e-+2H+═HOOC-CHO+H2O,可知生成1mol乙醛酸,由于两极均有乙醛酸生成所以生成的乙醛酸为2mol,故B错误;
C、根据质子的移动方向,确定M电极是阳极,阳极上发生失电子的氧化反应:2Cl--2e-═Cl2↑,故C正确;
D、氯气具有氧化性,能将醛基氧化为羧基,乙二醛与M电极的产物反应生成乙醛酸的化学方程式为:Cl2+OHC-CHO+H2O═HOOC-CHO+2HCl,故D正确.
故选B.
点评 本题考查了电解池原理的分析应用,把握电解池原理以及电解过程中电子守恒的计算应用,掌握基础是关键,题目难度中等.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HO(CH2)2CHO | B. | HO(CH2)2COOH | C. | HOOCCOOH | D. | (CH3)3CCOOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z、W、M的原子半径由大到小的顺序为Z>W>M | |
| B. | M分别与Z、W所形成的物质的晶体类型相同 | |
| C. | X2Y2易溶于X2Y中,是由于X2Y2与X2Y能形成分子间氢键 | |
| D. | 将Z2Y在空气中加热可得到Z2Y2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验组 | 温度/C | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
| C | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | … | 6 |
| 2 | 900 | 6 | 3 | … | 1.5 | 3 |
| 3 | 900 | … | … | … | … | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论 | |
| ① | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| ④ | 常温下白磷自燃而氮气在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH4+ |
| A. | ①②③ | B. | ①③⑤ | C. | ②③⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com