
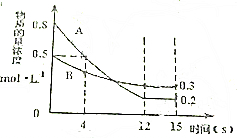
 已知:反应aA(g)+bB(g)?cC(g)某温度下,在2L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示.
已知:反应aA(g)+bB(g)?cC(g)某温度下,在2L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示.分析 依据图象可知:AB为反应物,且A的初始物质的量浓度为0.8mol/L,B的初始浓度为0.5mol/L,反应进行到12s时达到平衡,此时A的平衡浓度为0.2mol/L,B的平衡浓度为0.3mol/L,据此可以计算出12s内用A表示的化学反应速率,可以计算出a与b的比值,利用题给4s内v(C)=0.05mol•L-1•s-1,计算出abc的最简整数比,然后绘制图象,由此分析解答.
解答 解:(1)从反应开始到12s时,A的浓度变化量△c=0.8mol/L-0.2mol/L=0.6mol/L,时间为12s,故v(A)=$\frac{△c}{△t}$=0.05mol/(L•s),故答案为:0.05mol/(L•s);
(2)12s时,B的浓度变化量△c=0.5mol/L-0.3mol/L=0.2mol/L,故a:b=0.6:0.2=3:1,经测定前4s内v(C)=0.05mol•L-1•s-1,此时A浓度变化为:0.8mol/L-0.5mol/L=0.3mol/L,此时v(A)=$\frac{0.3mol/L}{4s}$=0.075mol/(L•s),即v(A):v(C)=0.075:0.05=3:2,故a:b:c=3:1:2,故化学反应方程式为:3A(g)+B(g)?2C(g),a、b、c依次为3、1、2,故答案为:3、1、2;
(3)平衡是A变化量为0.6,故C变化量为0.4,可绘制图象如下: ,故答案为:
,故答案为: .
.
点评 本题主要考查化学平衡的变化图象,题目难度不大,可以根据所学知识进行回答,本题要注意化学方程式的确定方法,以及反应速率计算,把握好相关概念和公式的理解及运用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
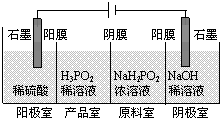 次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙醇含有2NA个碳子 | |
| B. | 常温常压下,17g羟基含有9NA个电子 | |
| C. | 28g乙烯和丙烯(C3H6)的混合气体中含有的碳原子数为2NA | |
| D. | 1molNa被完全氧化生成Na2O2,失去NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极质量不变 | B. | 电流通过导线由铜片流向银片 | ||
| C. | 烧杯中Ag+浓度逐渐减小 | D. | 电池工作时,铜片失电子,被还原 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一上第一次月考化学卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
A.铜和醋酸反应:Cu+2CH3COOH 2CH3COO-+Cu2++H2↑
2CH3COO-+Cu2++H2↑
B.氧化铁与稀盐酸反应:Fe2O3+6H+ 2Fe3++3H2O
2Fe3++3H2O
C.锌与硝酸银溶液反应:Zn+Ag+ Zn2++Ag
Zn2++Ag
D.稀硝酸和石灰乳反应:H++OH- H2O
H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆一中高一上10月月考化学试卷(解析版) 题型:选择题
VmL密度为ρg/mL的某溶液,含有相对分子质量为M的溶质mg,该溶液中溶质的质量分数为w%,物质的量浓 度为cmol/L那么下列关系式正确的是( )
度为cmol/L那么下列关系式正确的是( )
A.m=(VρW)/1000 B.c=(1000ρW)/M C.W%=[cM/(10ρ)]% D.C=m/(VM)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com