
分析 反应中,化合价升高元素是氯元素,失电子,化合价降低元素是锰元素,得到电子,化合价升高数=化合价降低数=转移电子数=10,单线桥表,反应中电子转移的方向和数目为:
(1)根据方程式结合3.16g KMnO4反应计算生成的氯气,根据氯气的量计算被氧化的HCl的物质的量和转移电子数;
(2)根据根据方程式结合3.16g KMnO4反应计算生成的氯气的体积;
(3)根据氯原子守恒计算.
解答 解:反应中,化合价升高元素是氯元素,失电子,化合价降低元素是锰元素,得到电子,化合价升高数=化合价降低数=转移电子数=10,单线桥表,反应中电子转移的方向和数目为: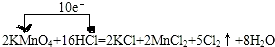 ;
;
故答案为: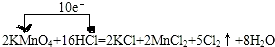 ;
;
(1-2)2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O反应中,高锰酸钾中锰元素化合价降低,所以高锰酸钾做氧化剂,氯化氢中氯元素化合价升高,氯化氢为还原剂,生成5mol氯气,转移10mol电子,所以当3.16g即$\frac{3.16}{39+55+64}$=0.02mol KMnO4与50mL 12mol•L-1过量浓盐酸完全反应,生成氯气为0.05mol,标况下体积为0.05mol×22.4L/mol=1.12L;则被氧化的HCl的物质的量为0.1mol;转移了0.1NA 个电子;
故答案为:(1)0.1mol;0.1NA;(2)1.12L;
(3)根据2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O反应,生成氯气为0.05mol,所以根据氯原子守恒,在反应后的溶液中加足量的AgNO3溶液可生成生成(0.05×12-0.05×2)×143.5=71.75g,答:反应后的溶液中加足量的AgNO3溶液可生成71.75g沉淀.
点评 本题考查了氧化还原反应的相关概念和计算,明确氧化还原反应的实质是解题关键,注意分析化合价判断电子的转移数目,依据方程式计算,题目难度不大.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:解答题
 甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.工业生产甲醇的常用方法是:CO(g)+2H2(g)?CH3OH(g)△H=-90.8 kJ•mol-1
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.工业生产甲醇的常用方法是:CO(g)+2H2(g)?CH3OH(g)△H=-90.8 kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 | |
| 第一次称量 | 第二次称量 | ||
| 11.710g | 22.700g | 18.621g | a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定温度下,向容积为2L的密闭容器中通入两种气体,发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断不合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体,发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断不合理的是( )| A. | 该反应的化学方程式为3B+4C═6A+2D | |
| B. | 反应进行到1s时,v(A)和v(D)不相等 | |
| C. | 反应开始到6s,B的平均反应速率为0.1mol•L-1•s-1 | |
| D. | 反应进行到6s时,各物质的浓度不再变化,达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-143kJ•mol-1 | B. | 2H2(g)+O2(g)═2H2O(g)△H=-286 kJ•mol-1 | ||
| C. | 2H2O(l)═2H2(g)+O2(g)△H=+286 kJ•mol-1 | D. | H2O(l)═H2(g)+$\frac{1}{2}$O2(g)△H=+286 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4Fe(OH)2+2H2O+O2═4Fe(OH)3 | B. | 2Fe+2H2O+O2═2Fe(OH)2 | ||
| C. | 负极反应:Fe-3e-═Fe3+ | D. | 正极反应:2H2O+O2+4e--═4OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com