
分析 (1)恒容的条件等效平衡,极端转化相同物质的物质的量,则各原子守恒,分别根据氮和氢守恒,得到x、y、z应满足的关系;
(2)恒压条件下的等效平衡是用极端转化后相同物质的量成比例,由此分析解答;
(3)N2+3H2?2NH3,
起始:1 3 0
转化:0.5a 1.5a a
即一边倒的极限氮气的转化率为:$\frac{0.5a}{1}$=0.5a,由于二者是等效平衡,所以一边倒的极限氮气的转化率相等,即一边倒转化的n(N2)=(x+$\frac{z}{2}$)×0.5a,所以生成的n(NH3)=$\frac{n(N{\;}_{2})}{2}$=$\frac{\frac{x+\frac{z}{2}}{0.5a}}{2}$=0.25ax+0.125az,由此分析解答.
解答 解:(1)恒容的条件等效平衡,极端转化相同物质的物质的量,则各原子守恒,由氮守恒可知:2x+z=2,氢守恒可知:2y+3z=6,故答案为:2x+z=2、2y+3z=6;
(2)由反应方程式N2+3H2?2NH3,将氨气完全转化为氮气和氢气,则氮气的物质的量为:x+$\frac{z}{2}$,氢气的物质的量为:y+$\frac{3z}{2}$,所以$\frac{x+\frac{z}{2}}{y+\frac{3z}{2}}=\frac{1}{3}$,即3x=y,故答案为:3x=y,z为任意值;
(3)N2+3H2?2NH3,
起始:1 3 0
转化:0.5a 1.5a a
即一边倒的极限氮气的转化率为:$\frac{0.5a}{1}$=0.5a,由于二者是等效平衡,所以一边倒的极限氮气的转化率相等,即一边倒转化的n(N2)=(x+$\frac{z}{2}$)×0.5a,所以生成的n(NH3)=$\frac{n(N{\;}_{2})}{2}$=$\frac{\frac{x+\frac{z}{2}}{0.5a}}{2}$=0.25ax+0.125az,故答案为:0.25ax+0.125az.
点评 本题较难,考查化学平衡中等效平衡的计算,明确温度与压强不变时,起始反应物的量成正比则平衡等效是解答本题的关键.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
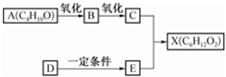 如图中X是无支链的、具有果香味的合成香料,可用于调配多种果香型香精.已知D在标准状况下的密度为1.25g•L-1,其产量可以用来衡量一个国家石油化工发展水平.E是生活中常见的一种有机物.各物质间转化关系如图:
如图中X是无支链的、具有果香味的合成香料,可用于调配多种果香型香精.已知D在标准状况下的密度为1.25g•L-1,其产量可以用来衡量一个国家石油化工发展水平.E是生活中常见的一种有机物.各物质间转化关系如图: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定含有乙烯 | |
| B. | 可能为等物质的量甲烷和丙烯的混合物 | |
| C. | 可能为乙烷和丙烷的混合物 | |
| D. | 一定为乙烯和甲烷的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定条件下,根据溶液导电性的变化,可以判断出电解质的强弱.已知溶液的导电性与溶液自由移动离子的浓度及其所带电荷有关.离子浓度越大,所带电荷越多,导电性就越强,如图是将KOH溶液分别加入到相同物质的量浓度的HCl溶液和CH3COOH溶液中的导电性变化情况.下列说法正确的是( )
在一定条件下,根据溶液导电性的变化,可以判断出电解质的强弱.已知溶液的导电性与溶液自由移动离子的浓度及其所带电荷有关.离子浓度越大,所带电荷越多,导电性就越强,如图是将KOH溶液分别加入到相同物质的量浓度的HCl溶液和CH3COOH溶液中的导电性变化情况.下列说法正确的是( )| A. | 虚线表示CH3COOH溶液,实线表示HCl溶液 | |
| B. | 由图可知,HCl溶液中加入KOH溶液后导电性将进一步增强 | |
| C. | 由图可知,加入KOH溶液到一定量后,导电性均会比原来强 | |
| D. | 若用NH3•H2O溶液加入到HCl溶液中,则导电性变化如图 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸与醇反应一定能生成酯,且酯化反应是可逆反应 | |
| B. | CO2通入饱和苯酚钠溶液,用分液法可以得到苯酚 | |
| C. | 有机物 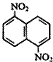 的n溴代物的同分异构体的数目与m溴代物的同分异构体的数目相等,则m、n一定满足的关系式m+n=6 的n溴代物的同分异构体的数目与m溴代物的同分异构体的数目相等,则m、n一定满足的关系式m+n=6 | |
| D. | 等物质的量的烃或烃的含氧衍生物A和B完全燃烧时,消耗氧气的量相等.则A和B的分子量相差可能为18n或44n(n为正整数) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO | B. | 石脑油(C5H12,C6H14) | ||
| C. | CH4 | D. | 焦炭 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com