
下图所示为某化学兴趣小组设计的乙醇催化氧化及其产物检验的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。
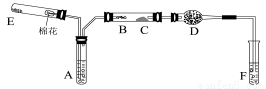
图中:A为无水乙醇(沸点为78℃),B为绕成螺旋状的细铜丝或银丝,C为无水CuSO4粉末,D为碱石灰,F为新制的氢氧化铜悬浊液
已知:含—CHO的物质在加热条件下与新制的Cu(OH)2悬浊液反应生成砖红色沉淀。
(1)在上述装置中,实验时需要加热的仪器为(填某部位的代号) 。
(2)为使A中乙醇平稳气化成乙醇蒸气,常采用的方法是_________。
D处使用碱石灰的作用是 。
(3)E处是一种纯净物,该物质为 。
(4)写出乙醇发生催化氧化的化学方程式 。
(1)E、A、B、F (2)水浴加热; 防止F中的水蒸气进入C中与无水CuSO4作用,影响产物水的检验 (3)2KMnO4  K2MnO4+MnO2+O2↑ (4)2CH3CH2OH+O2
K2MnO4+MnO2+O2↑ (4)2CH3CH2OH+O2 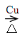 2CH3CHO+2H2O
2CH3CHO+2H2O
【解析】
试题解析:(1)固体加热制氧气需要加热,乙醇变为蒸汽需加热,乙醇的催化氧化要加热,醛和与新制的Cu(OH)2悬浊液反应也要加热;(2)为使A中乙醇平稳气化成乙醇蒸气,常采用的方法是水浴加热;碱石灰具有吸水作用,D处使用碱石灰可以防止F中的水蒸气进入C中与无水CuSO4作用,否则会影响产物水的检验;(3)固体纯净物加热制氧气的只能是加热高锰酸钾制氧气,反应为:2KMnO4  K2MnO4+MnO2+O2↑;(4)乙醇在通过催化剂时,可以被氧化为乙醛,反应的方程式为:2CH3CH2OH+O2
K2MnO4+MnO2+O2↑;(4)乙醇在通过催化剂时,可以被氧化为乙醛,反应的方程式为:2CH3CH2OH+O2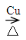 2CH3CHO+2H2O。
2CH3CHO+2H2O。
考点:乙醇的催化氧化实验


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年湖北省高一上学期期中化学试卷(解析版) 题型:选择题
下列实验操作均要用到玻璃棒,其中玻璃棒的作用及其目的相同的是
 ①过滤 ②蒸发 ③溶解 ④向容量瓶中转移液体
①过滤 ②蒸发 ③溶解 ④向容量瓶中转移液体
 A.①和④ B.①和③ C.①和② D.③和④
A.①和④ B.①和③ C.①和② D.③和④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省高二上学期10月月考化学试卷(解析版) 题型:选择题
下列叙述错误的是
A.乙烯和苯都能使溴水褪色,褪色的原因相同
B.淀粉、油脂、蛋白质都能水解,但水解产物不同
C.煤油可由石油分馏获得,可用作燃料和保存少量金属钠
D.乙醇、乙酸、乙酸乙酯都能发生取代反应、乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北武汉新洲三中高二10月月考化学(A卷)试卷(解析版) 题型:选择题
将2molSO2 和1molO2充入一容积固定的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g) 2SO3(g)。下列哪些量不再变化时,不能说明化学反应已达平衡状态( )
2SO3(g)。下列哪些量不再变化时,不能说明化学反应已达平衡状态( )
A.混合气体的密度 B.混合气体的压强
C.混合气体的总物质的量 D.混合气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北武汉新洲三中高二10月月考化学(A卷)试卷(解析版) 题型:选择题
1gH2在O2中燃烧生成液态水放出142.9kJ的热量,则下列热化学方程式正确的是( )
A.2H2(g) + O2(g) = 2H2O(l) △H=-142.9kJ·mol-1
B.2H2(g) + O2(g) = 2H2O(l) ;△H=-571.6kJ·mol-1
C.H2(g) + 1/2O2(g) = H2O(g) ;△H=-285.8kJ·mol-1
D.H2(g) + 1/2O2(g) = H2O(l) ;△H=- 285.8kJ
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省绍兴市高一上学期期中化学试卷(解析版) 题型:选择题
燃烧某有机物只生成二氧化碳8.8g和水2.7g,下列说法中,正确的是
A.该有机物的最简式为C2H3
B.该有机物分子中肯定不含有碳碳叁键
C.该有机物不可能含有氧元素
D.该有机物不可能是丁烷
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省绍兴市高一上学期期中化学试卷(解析版) 题型:选择题
某有机物的结构简式为

下列叙述不正确的是
A.1mol该有机物能与足量金属钠反应放出1molH2
B.能与乙醇发生酯化反应
C.1mol该有机物在催化剂作用下最多能与1molH2发生还原反应
D.1mol该有机物能与足量NaHCO3溶液反应放出2 molCO2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省温州市十校联合体高二上学期期中联考化学试卷(解析版) 题型:填空题
(16分)Ⅰ.苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)  C8H8(g)+H2(g) ΔH=120 kJ·mol-1。某温度下,将0.40 mol苯乙烷,充入2 L真空密闭容器中发生反应,
C8H8(g)+H2(g) ΔH=120 kJ·mol-1。某温度下,将0.40 mol苯乙烷,充入2 L真空密闭容器中发生反应,
测定不同时间该容器内气体物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
(1)当反应进行到20 min时,该段时间内H2的平均反应速率是_____ ___。
(2)该温度下,该反应的化学平衡常数是________ ________。
(3)若保持其他条件不变,用0.50 mol H2(g)和0.50 mol C8H8(g)合成C8H10(g),当有30 kJ热量放出时,该反应中H2的转化率是________________。此时,该合成反应是否达到了平衡状态?________(填“是”或“否”),且正反应速率 逆反应速率(填大于、小于或等于)
(4)对于反应C8H10(g)  C8H8(g)+H2(g),下列说法正确的是
C8H8(g)+H2(g),下列说法正确的是
A、恒温恒容条件下C8H10(g)和C8H8(g)生成速率相等能说明该反应达到平衡状态
B、压强增大该反应的平衡常数也增大
C、在恒温恒压条件下,有2 mol C8H10(g)在容器中完全反应,该反应的反应热为ΔH1,另有4 mol C8H10(g)在容器中完全反应,该反应的反应热为ΔH2,则ΔH2=2ΔH1
Ⅱ.在一容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)  2NH3(g) ΔH<0,反应中NH3的物质的量浓度的变化情况如下图:
2NH3(g) ΔH<0,反应中NH3的物质的量浓度的变化情况如下图:

(1)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为________。
①0.20 mol·L-1 ②0.12 mol·L-1 ③0.10 mol·L-1 ④0.08 mol·L-1
(2)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末达到此平衡时NH3浓度的变化曲线。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省温州市十校联合体高一上学期期中联考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B.25℃,1.01×105Pa,64g SO2中含有的原子数为3NA
C.在常温常压下,11.2L Cl2含有的分子数为0.5NA
D.在标准状况下,11.2L H2O含有的分子数为0.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com