
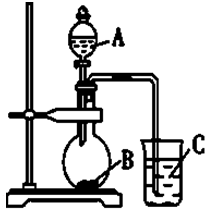
分析 (1)元素的非金属性越强,其最高价含氧酸的酸性越强,由图可知应是利用最高价含氧酸的酸性强弱比较,利用强酸制弱酸原理分析;
(2)A为常温下能与铜反应的强酸,A为硝酸,B为碳酸钙或碳酸钡,C为硅酸钠溶液,烧瓶中硝酸和碳酸盐反应生成二氧化碳;
(3)图中C烧杯中为二氧化碳与硅酸钠反应;
(4)根据实验现象和元素最高价含氧酸的酸性强弱判断元素非金属性强弱,酸性越强,非金属性越强,推知N、C、Si三种元素非金属性的强弱.
解答 解:(1)根据题干信息:甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究,硝酸的酸性强于碳酸,碳酸酸性强于硅酸,最高价氧化物对应水化物酸性越强,则原子的非金属性越强,所以A为稀硝酸,块状固体B,所以B为碳酸钙或碳酸钡,C为硅酸钠溶液,化学式分别为:HNO3、CaCO3/BaCO3、Na2SiO3,
故答案为:HNO3;CaCO3/BaCO3;
(2)硝酸的酸性强于碳酸,碳酸酸性强于硅酸,最高价氧化物对应水化物酸性越强,A为硝酸,B为碳酸钙或碳酸钡,C为硅酸钠溶液,硝酸与碳酸钙或碳酸钡反应生成二氧化碳、硝酸钙或硝酸钡和水,其反应的离子方程式为:CaCO3+2H+═Ca2++CO2↑+H2O或BaCO3+2H+═Ba2++CO2↑+H2O,
故答案为:CaCO3+2H+═Ca2++CO2↑+H2O或BaCO3+2H+═Ba2++CO2↑+H2O;
(3)图C烧杯中为二氧化碳与硅酸钠反应,其反应的方程式为:Na2SiO3+CO2+H2O═H2SiO3↓+Na2CO3(CO2不足),或是Na2SiO3+2CO2+2H2O═H2SiO3↓+2NaHCO3(CO2过量),
故答案为:Na2SiO3+CO2+H2O═H2SiO3↓+Na2CO3(CO2不足),或是Na2SiO3+2CO2+2H2O═H2SiO3↓+2NaHCO3(CO2过量);
(4)A中反应是碳酸盐和硝酸反应生成二氧化碳,证明硝酸的酸性强于碳酸,C中为Na2SiO3溶液,二氧化碳通入反应生成硅酸沉淀,证明碳酸的酸性强于硅酸,所以碳酸、硝酸、硅酸的酸性强弱顺序是硝酸、碳酸、硅酸,根据实验现象和元素最高价含氧酸的酸性强弱判断元素非金属性强弱,酸性越强,非金属性越强,推知N、C、Si三种元素非金属性的强弱为N>C>Si,
故答案为:N>C>Si.
点评 本题考查探究元素周期律实验方案设计,综合运用元素及其化合物、元素周期律与非金属性强弱比较的有关知识是解答关键,具有较强的综合性,注意实验设计的原理和方法,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3 | B. | Na2S | C. | (NH4)2CO3 | D. | Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| ① | Na2O2、MnO4-、H+ | Mn2+、O2、H2O、Na+ |
| ② | Na2O2、H2O | NaOH、O2 |
| ③ | Na2O2、FeSO4 | Na2FeO4 |
| A. | 三组中Na2O2均作氧化剂 | |
| B. | 第②组反应中生成1molO2,转移电子的物质的量为4mol | |
| C. | 第③组反应中产物还有Na2SO4 | |
| D. | 氧化性的强弱顺序为Na2O2>MnO4->FeO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,3.2 g O3所含电子数为1.2 NA | |
| B. | 标准状况下,2.24 L CCl4中含有的C-Cl键的数目为0.4 NA | |
| C. | CO与N2互为等电子体,标准状况下11.2 L CO与0.5 molN2所含电子数相等 | |
| D. | 将0.1 mol 氯化铁溶于1 L水中,所得溶液含有0.1 NA Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①②⑤ | C. | ①②④ | D. | ②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com