
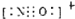
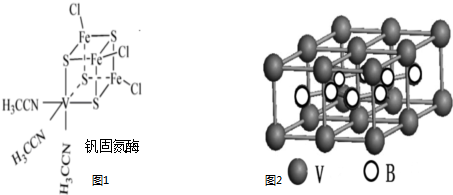
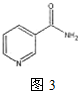
| 1 |
| 2 |
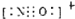 ,故正确;
,故正确;| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 8 |


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
| A、甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
| B、米酒变酸的过程涉及了氧化反应 |
| C、乙烯和聚丙烯都能与氢气在一定条件下发生加成反应 |
| D、淀粉、葡萄糖、脂肪和蛋白质在一定条件下都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
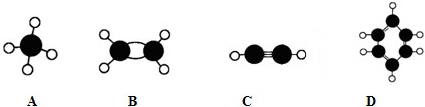
查看答案和解析>>
科目:高中化学 来源: 题型:
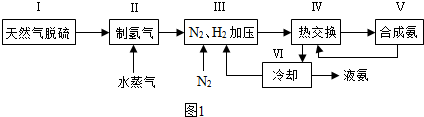
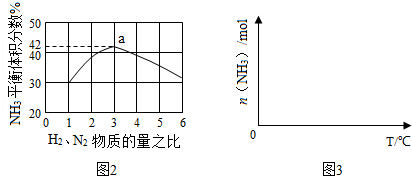
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
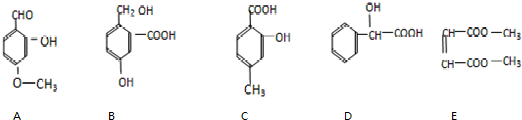
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用酸性高锰酸钾即可鉴别苯酚溶液,2,4-己二烯和甲苯 |
B、按系统命名法化合物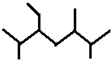 的名称为:2,5,6-三甲基-3-乙基庚烷 的名称为:2,5,6-三甲基-3-乙基庚烷 |
C、新型解热镇痛抗炎药贝诺酯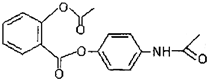 在酸性条件下完全水解可以得到3种有机物 在酸性条件下完全水解可以得到3种有机物 |
D、β-月桂烯的结构如图 ,一分子该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种 ,一分子该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com