
分析 (1)使水的电离平衡向右移动的方法有:升高温度、加入含有弱根离子的盐等,如果溶液呈酸性,说明加入的物质和氢氧根离子反应,导致溶液中氢氧根离子浓度小于氢离子浓度而使溶液呈酸性;
(2)100℃沸水显示中性,根据中性环境下pH试纸的颜色来确定即可;在25℃时,水的pH=7,温度升高,则pH增大,水在任何温度下均为中性;
(3)用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH,不能用水湿润pH试纸,否则稀释了待测溶液,使溶液的酸碱性减弱,测定结果不准确,据此进行分析判断.
解答 解:(1)A.向水中加入NaHSO4,NaHSO4电离出氢离子,抑制水电离,平衡逆向移动,导致溶液中C(H+)>C(OH-),溶液呈酸性,故错误;
B.向水中加入Cu(NO3)2,Cu(NO3)2是强酸弱碱盐能水解,铜离子和氢氧根离子结合生成氢氧化铜,从而促进水电离,导致溶液中C(OH-)<C(H+),溶液呈酸性,故正确;
C.水的电离是吸热反应,加热至100℃,促进水电离,溶液C(OH-)=C(H+),溶液呈中性,故错误;
D.在水中加入NaHCO3固体,NaHCO3是强碱弱酸的酸式盐能水解,碳酸氢根离子与氢离子结合生成弱电解质,从而促进水电离,导致溶液中C(OH-)>C(H+),溶液呈碱性,故错误;
故选B;
(2)温度升高会促进水的电离,所以水的pH会减小,所以100℃沸水仍然是中性的,但此时的pH值小于7,pH试纸测定溶液的酸碱性时,试纸为淡黄色,水在任何温度下均为中性的,故答案为:淡黄;中;<;
(3)溶液pH的测得值为8,说明溶液为碱性溶液,由于碱性溶液稀释后,溶液碱性减弱,测定的pH偏小,所以该氨基酸溶液的实际pH应大于8,
故答案为:>.
点评 本题考查了水的电离平衡和溶液酸碱性的关系,题目难度不大,注意从题干中提取pH试纸的使用的有效信息.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:解答题
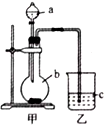 某同学想通过比较元素的最高价氧化物对应的水化物的酸性强弱来证明硫和碳的得电子能力强弱,设计了如图所示装置进行探究.
某同学想通过比较元素的最高价氧化物对应的水化物的酸性强弱来证明硫和碳的得电子能力强弱,设计了如图所示装置进行探究.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 观察焰色反应实验为黄色火焰,则可证明该溶液中含有Na+ | |
| B. | 金属单质导电与电解质溶液导电原因是一样的 | |
| C. | 常温下浓硫酸与铁不反应,故常温下可用铁制容器贮藏贮运浓硫酸 | |
| D. | 可用Na与MgCl2溶液反应制Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 单质A、B、C和化合物D、E、F,在一定条件下有如图的转化关系(可能有部分生成物未标出),请回答下列问题:
单质A、B、C和化合物D、E、F,在一定条件下有如图的转化关系(可能有部分生成物未标出),请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2、CH4在负极失去电子,发生氧化反应 | |
| B. | 从产物推断,两种燃料电池的氧化剂均为O2 | |
| C. | 燃料电池将化学能直接转变为电能,能量转化率高 | |
| D. | 分别将1 mol H2与1 mol CH4做燃料电池的燃料,转移的电子一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,其反应方程式为
,其反应方程式为 (不要求标出反应条件).
(不要求标出反应条件). (不要求标出反应条件).
(不要求标出反应条件).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com