
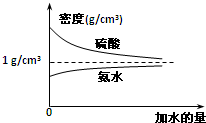
 已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:| 溶液 | 溶质的物质的量浓度 | 溶液的密度/g?cm-3 |
| 硫酸 | 4mol?L-1 | ρ1 |
| 2mol?L-1 | ρ2 | |
| 氨水 | 4mol?L-1 | ρ3 |
| 2mol?L-1 | ρ4 |
| 1000ρw |
| M |
| 1000ρw |
| M |
| 3.4 |
| ρ4 |
| 3.4 |
| ρ4 |
| 20%+10% |
| 2 |
| ||
| 98 |
| 2 |
| 5ρ1 |
| 100+V |
| 1000ρ2 |
| 2 |
| 5ρ1 |
| 200ρ2-100ρ1 |
| ρ1 |
| 200ρ2-100ρ1 |
| ρ1 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、H与O可形成既含极性共价键又含非极性共价键的化合物 |
| B、非金属元素组成的化合物中只含共价键 |
| C、HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
| D、Na2O与Na2O2中阴阳离子个数比不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
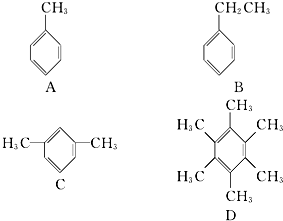
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
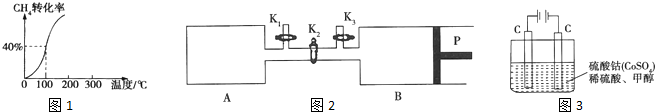
| 3 |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②和③ | B、①②③ |
| C、②④⑤⑦ | D、②③⑤⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com