
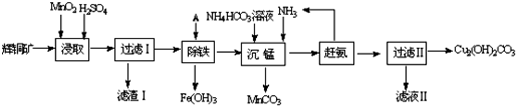
分析 辉铜矿主要成分为Cu2S,含少量Fe2O3、SiO2等杂质,加入稀硫酸和二氧化锰浸取,过滤得到滤渣为MnO2、SiO2、单质S,滤液中含有Fe3+、Mn2+、Cu2+,调节溶液PH除去铁离子,加入碳酸氢铵溶液沉淀锰过滤得到滤液赶出氨气循环使用,得到碱式碳酸铜,
(1)①由滤渣1的成份可知反应的化学方程式是:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,根据方程式判断;
②根据Ksp=c(Cu2+)•[c(OH-)]2=2×10-20,根据OH-离子的浓度计算Cu2+离子的浓度;
③“沉锰”(除Mn2+)过程中,加入碳酸氢铵和氨气,生成碳酸锰沉淀,以此可书写反应的离子方程式;
④滤液Ⅱ主要是硫酸铵溶液通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铵晶体;
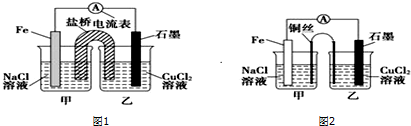
(2)①图2为原电池反应,Fe为负极,发生反应:Fe-2e-=Fe2-,石墨为正极,发生反应Cu2++2e-=Cu;根据甲乙两池得失电子相等计算甲、乙两池电解质溶液的总质量与实验开始前的电解质溶液的总质量差;
②根据条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置是电解池,甲装置是原电池.
解答 解:(1)①由滤渣1的成份可知反应的化学方程式是:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,反应中Mn元素化合价降低,被还原,MnO2为氧化剂,因二氧化硅与酸不反应,则滤渣Ⅰ的成分为MnO2、S和SiO2,
故答案为:MnO2;SiO2;
②溶液pH=4,c(OH-)=10-10mol/L,则稀释后的溶液中铜离子浓度最大不能超过:$\frac{2.2×1{0}^{-20}}{(1{0}^{-10})^{2}}$mol/L=2.2 mol/L,
故答案为:2.2;
③“沉锰”(除Mn2+)过程中,加入碳酸氢铵和氨气,生成碳酸锰沉淀,反应的离子方程式为Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O,
故答案为:Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O;
④滤液Ⅱ主要是硫酸铵溶液通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铵晶体,
故答案为:(NH4)2SO4;
(2)①图2为原电池反应,Fe为负极,发生:Fe-2e-=Fe2-,石墨为正极,发生Cu2++2e-=Cu,总反应式为Fe+Cu2+═Fe2++Cu,一段时间后,两电极质量相差6g,
则 Fe+Cu2+═Fe2++Cu 两极质量差△m 转移电子
56g 64g 56g+64g=120g 2mol
6g n
则:n=0.1mol,转移电子的物质的量为0.1mol;
甲池中溶解铁成为亚铁离子共0.05mol质量为2.8克的同时,盐桥中的氯离子会进入电解质溶液,根据电荷守恒氯离子进入溶液为0.1摩尔,质量为3.55克.同样乙池中析出铜0.05摩尔,质量减少3.2克的同时,会有0.1摩尔的钾离子进入溶液,其质量为3.9克,甲池增加的质量为2.8g+3.55 g=6.35g,乙池增加的质量为3.9-3.2=0.7 g
总质量差值=6.35-0.7=5.65 g,
故答案为:0.1;5.65;
②其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置是电解池,甲装置是原电池,Fe是负极,发生:Fe-2e-=Fe2-,Cu丝是正极,正极发生 O2+2H2O+4e-═4OH-,呈碱性,则甲池铜丝附近溶液的pH增大,乙池中与铜线相连石墨电极是阳极,该极上发生的反应式为2Cl--2e-=Cl2↑,与铁丝相连石墨电极是阴极,发生反应:Cu2++2e-=Cu,
故答案为:增大;O2+2H2O+4e=4OH-;阴.
点评 本题考查物质制备和原电池原理,为高频考点,涉及氧化还原反应、物质分离和提纯、原电池有关计算等知识点,明确实验原理、物质性质差异性、基本理论是解本题关键,难点是判断(1)流程图中发生的反应及分离提纯方法,题目难度中等.


科目:高中化学 来源: 题型:解答题
 +2
+2 $\stackrel{碱}{→}$
$\stackrel{碱}{→}$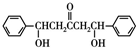 .
. .
. .
. (无机物任选).
(无机物任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在中和滴定实验中,锥形瓶须用待测液润洗 | |
| B. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| C. | 用标准盐酸溶液滴定未知浓度NaOH溶液时,若滴定前滴定管尖嘴处有气泡未排出而滴定后消失,则能使所测结果偏高 | |
| D. | 滴定时可将KMnO4溶液装在碱式滴定管中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
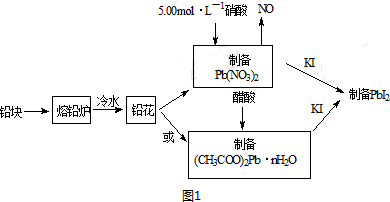
| 实验内容 | 实验方法 | 实验现象及原因分析 |
| ①碘离子浓度增大对平衡的影响 | 取PbI2饱和溶液少量于一支试管中,再滴入几滴NaI饱和溶液 | 现象:溶液中c(I-)增大,使Q大于了PbI2的Ksp |
| ②铅离子浓度减小对平衡的影响 | 取PbI2悬浊液少量于一支试管中,再加入少量NaCl饱和溶液 | 现象:黄色浑浊消失 原因:形成PbCl42-,导致溶液中c(Pb2+)减小,使Qc小于PbI2的Ksp |
| ③铅离子和碘离子浓度都减小对平衡的影响 | 在PbI2悬浊液中滴入几滴FeCl3饱和溶液 | 现象:黄色浑浊消失 写出反应的离子方程式:PbI2+2Fe3++4Cl-=PbCl42-+2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
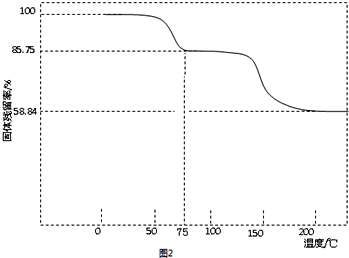
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
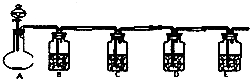 设计一实验将只含有Na2SO4、Na2SO3、Na2CO3的白色固体中的三种成分检验出来.取一定量的白色固体与烧瓶A中,通过分液漏斗加入液体a,如图所示:
设计一实验将只含有Na2SO4、Na2SO3、Na2CO3的白色固体中的三种成分检验出来.取一定量的白色固体与烧瓶A中,通过分液漏斗加入液体a,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
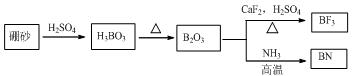
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
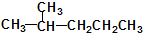 ②
②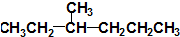 ③
③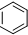
 ⑥
⑥

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com