
分析 (1)0.1mol/L CH3COOH溶液存在电离平衡,溶液显酸性;溶液中阴阳离子所带电荷总数相同;
(2)0.1mol/L CH3COONa溶液中醋酸根离子水解溶液显碱性;
(3)①0.1mol/L CH3COOH溶液中存在电离平衡;
②0.1mol/L CH3COONa溶液中醋酸根离子水解溶液显碱性;
(4)等浓度的醋酸和醋酸钠溶液中,醋酸的电离程度大于醋酸根离子的水解程度.
解答 解:(1)0.1mol/L CH3COOH溶液存在电离平衡,溶液显酸性,溶液①的pH<7,溶液中离子的电荷守恒的关系式是c(H+)=c(CH3COO-)+c(OH-),
故答案为:<;c(H+)=c(CH3COO-)+c(OH-);
(2)0.1mol/L CH3COONa溶液中醋酸根离子水解溶液显碱性,CH3COO-水解显碱性,反应的离子方程式为:CH3COO-+H2O?CH3COOH+OH-,
故答案为:碱;CH3COO-+H2O?CH3COOH+OH-;
(3)①0.1mol/L CH3COOH溶液中存在电离平衡,溶液中c(CH3COO-)都小于0.1mol/L,
②0.1mol/L CH3COONa溶液中醋酸根离子水解溶液显碱性,c(CH3COO-)都小于0.1mol/L,
故答案为:bc;
(4)等浓度的醋酸和醋酸钠溶液中,醋酸的电离程度大于醋酸根离子的水解程度,若将①②两溶液按一定的量混合,混合后溶液显中性,则①②两溶液的体积关系是:①<②,故答案为:<.
点评 本题考查了弱电解质的电离及盐类的水解,注意强酸弱碱盐或强碱弱酸盐在水溶液里的水解都是微弱的,为易错点,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2CO3溶液显碱性:CO32-+2H2O═H2CO3+2OH- | |
| B. | HS-电离的离子方程式:HS-+H2O═H3O++S2- | |
| C. | 少量氢氧化钙溶液与碳酸氢钠溶液混合,反应的离子方程式:Ca2++2HCO3-+2OH-═CaCO3+2H2O+CO32- | |
| D. | 在0.5 mol•L-1的K2Cr2O7溶液中存在如下平衡:Cr2O72-+H2O═2CrO42-+2H+,其平衡常数的表达式为$\frac{{{c^2}(CrO_4^{2-})•{c^2}({H^+})}}{{c(C{r_2}O_7^{2-})}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ/mol:E反应物<E生成物 | |
| B. | CaCO3(s)═CaO(s)+CO2(g)△H=+178.2 kJ/mol:E反应物<E生成物 | |
| C. | HCl(g)═$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)△H=+92.3 kJ/mol:1 mol HCl在密闭容器中分解后放出92.3 kJ的热量 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol:含1 mol NaOH的烧碱溶液与含0.5 mol H2SO4的浓H2SO4混合后放出57.3 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
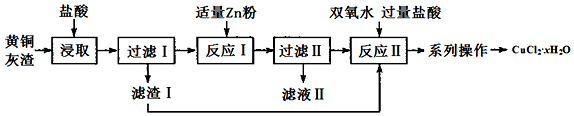
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示.下列说法错误的是( )
X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示.下列说法错误的是( )| A. | Q位于第三周期IA族 | |
| B. | X、Y、Z三种元素组成的化合物可能是盐或碱 | |
| C. | 简单离子半径:M->Q+>R2+ | |
| D. | Z与M的最高价氧化物对应水化物均为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
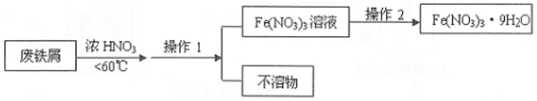
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2和NO | B. | NO2和CO2 | C. | N2和O2 | D. | O2和CO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com