


分析 (1)①2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g),硫由-2价变成+4价,所以生成1mol的二氧化硫转移6mol的电子;
②根据盖斯定律,反应Ⅰ:2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-1,反应Ⅱ:2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)△H=+116.0kJ•mol-1,Cu2S(s)+O2(g)═2Cu(s)+SO2(g)的△H=$\frac{△{H}_{Ⅰ}+△{H}_{Ⅱ}}{3}$;
③由反应Ⅰ:2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g),反应Ⅱ:2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)可知,反应Ⅰ生成2mol的氧化亚铜消耗2molCu2S,而2mol的氧化亚铜反应Ⅱ中消耗1mol的硫化亚铜,所以理论上m1:m2=2:1;
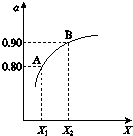
(2)①2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•mol-1,正反应是放热反应,所以升高温度平衡逆向移动,SO2(g)的平衡转化率α减小,而增大压强平衡正向移动,SO2(g)的平衡转化率α增大;反应达平衡后,由图可知,SO2的平衡转化率α=0.80,参加反应的二氧化硫为2mol×80%=1.6mol,则:
2SO2(g)+O2(g)?2SO3(g)
开始(mol):2 1 0
变化(mol):1.6 0.8 1.6
平衡(mol):0.4 0.2 1.6
所以平衡时浓度:c(SO2)=0.4mol/L,c(O2)=0.2mol/L,c(SO3)=1.6mol/L,故平衡常数k=$\frac{1.{6}^{2}}{0.{4}^{2}×0.2}$=80;
②碳酸钙的悬浊液中存在溶解平衡,所以而通入二氧化硫与水反应生成亚硫酸酸性比碳酸的酸性强;
(3)根据反应SO2+I2+2H2O=H2SO4+2HI,进行计算求解.
解答 解:(1)①2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g),硫由-2价变成+4价,所以生成1mol的二氧化硫转移6mol的电子,故答案为:6;
②根据盖斯定律,反应Ⅰ:2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-1,反应Ⅱ:2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)△H=+116.0kJ•mol-1,Cu2S(s)+O2(g)═2Cu(s)+SO2(g)的△H=$\frac{△{H}_{Ⅰ}+△{H}_{Ⅱ}}{3}$=$\frac{116-768.2}{3}$=-217.4kJ•mol-1,故答案为:-217.4;
③由反应Ⅰ:2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g),反应Ⅱ:2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)可知,反应Ⅰ生成2mol的氧化亚铜消耗2molCu2S,而2mol的氧化亚铜反应Ⅱ中消耗1mol的硫化亚铜,所以理论上m1:m2=2:1,故答案为:2:1;
(2)①2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•mol-1,正反应是放热反应,所以升高温度平衡逆向移动,SO2(g)的平衡转化率α减小,而增大压强平衡正向移动,SO2(g)的平衡转化率α增大,所以X代表的物理量是压强;反应达平衡后,由图可知,SO2的平衡转化率α=0.80,参加反应的二氧化硫为2mol×80%=1.6mol,则:
2SO2(g)+O2(g)?2SO3(g)
开始(mol):2 1 0
变化(mol):1.6 0.8 1.6
平衡(mol):0.4 0.2 1.6
所以平衡时浓度:c(SO2)=0.4mol/L,c(O2)=0.2mol/L,c(SO3)=1.6mol/L,故平衡常数k=$\frac{1.{6}^{2}}{0.{4}^{2}×0.2}$=80,故答案为:压强;80;
②碳酸钙的悬浊液中存在溶解平衡,所以而通入二氧化硫与水反应生成亚硫酸酸性比碳酸的酸性强,所以CaCO3悬浊液中存在CaCO3(s)?Ca2+(aq)+CO32-(aq),通入SO2时,水与SO2反应生成亚硫酸,亚硫酸电离出H+与CO32-结合,所以c(CO32-)减小,溶解平衡正向移动,故答案为:CaCO3悬浊液中存在CaCO3(s)?Ca2+(aq)+CO32-(aq),通入SO2时,水与SO2反应生成亚硫酸,亚硫酸电离出H+与CO32-结合,c(CO32-)减小,溶解平衡正向移动;
(3)根据反应SO2 +I2 +2H2O=H2SO4+2HI,
1mol 1mol
n(SO2) cV×10-3
所以 n(SO2)=cV×10-3mol,则SO2的质量分数的计算式:$\frac{cV×1{0}^{-3}mol×64g/mol×\frac{100}{20}}{mg}$×100%=$\frac{8cV}{25m}$×100%,故答案为:$\frac{8cV}{25m}$×100%.
点评 本题考查氧化还原反应与计算、盖斯定律的应用和化学平衡常数的计算等,难度中等,氧化还原反应的计算学生要学会应用关系式进行求解.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 实验小组为探究SO2的漂白性和还原性,设计了以下实验.
实验小组为探究SO2的漂白性和还原性,设计了以下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
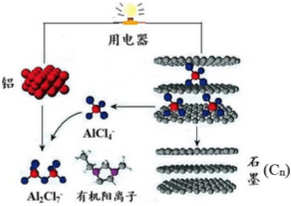 2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 放电时,铝为负极、石墨为正极 | |
| B. | 放电时,有机阳离子向铝电极方向移动 | |
| C. | 放电时的负极反应为:Al-3e-+7AlCl4-═4Al2Cl7- | |
| D. | 充电时的阳极反应为:Cn+AlCl4--e-═CnAlCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 麦芽糖水解的产物只有葡萄糖 | |
| B. | 苯酚可用于合成高分子化合物 | |
| C. | 油脂水解可以制取高级脂肪酸 | |
| D. | 鸡蛋清遇醋酸铅后产生的沉淀能重新溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸具有吸水性,因而能使蔗糖炭化 | |
| B. | 浓硫酸有氧化性,稀硫酸无氧化性 | |
| C. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 | |
| D. | 稀释浓硫酸时,应将其沿着器壁慢慢加入到水中,并用玻璃棒不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
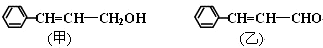
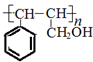 .
.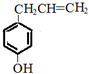 .
.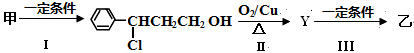
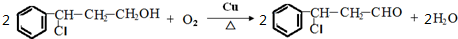 .
.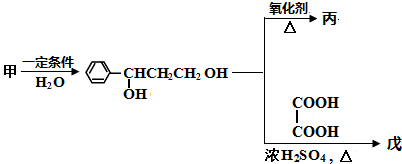
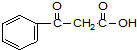 .
.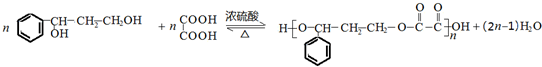 ;若戊为环状化合物,其结构简式是
;若戊为环状化合物,其结构简式是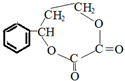 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的低价氧化物、Z的单质水溶液均具有漂白性,且与O3漂白的原理相同 | |
| B. | X与Z形成的化合物和W2Y的晶体类型相同 | |
| C. | 工业上常用电解相应的盐溶液制备W、X、Z的单质 | |
| D. | X元素的盐溶液可能呈酸性,也可能呈碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com