
短周期主族元素X、Y、Z、W的原子序数依次增大,原子半径:r(W)>r(Y)>r(Z)>r(X)。X与W同主族,Z原子最外层电子数是其内层电子总数的3倍,Z原子的核电荷数等于X、Y原子核电荷数之和。下列说法正确的是
A. 元素Z、W的简单离子的电子层结构不同
B. 元素Y的简单气态氢化物的热稳定性比Z的强
C. 仅由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性
D. 化合物X2Z2与W2Z2所含化学键类型完全相同
科目:高中化学 来源:2016-2017学年广西省桂林市高一下学期开学考化学试卷(解析版) 题型:选择题
已知某粒子AzRn+,则元素R原子的电子数为( )
A. Z B. A-Z C. A-Z+n D. A-Z-n
查看答案和解析>>
科目:高中化学 来源:2017届广西省桂林市、崇左市高三联合调研考试理科综合化学试卷(解析版) 题型:简答题
甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物。有关反应的热化学方程式如下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)= H2O(l)△H=-44kJ/mol
I.写出CH3OH(l)不完全燃烧生成CO和H2O(l)的热化学方程式:_________________。
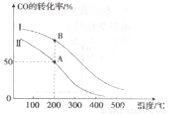
II. 工业上可用CO和H2制取甲醇:CO(g)+2H2(g)=CH3OH(g) △H=akJ/mol。为研究该反应平衡时CO转化率与反应物投料比(反应物投料比=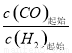 )以及温度的关系,研究小组在10L的密闭容器中进行模拟反应,并依反应数据绘出下图:
)以及温度的关系,研究小组在10L的密闭容器中进行模拟反应,并依反应数据绘出下图:
回答下列问题:
(1)反应热a____0(填“>”或“<”),判断理由是______。
(2)在其他条件相同,曲线I、II分别表示反应物投料比不同时的反应过程曲线。
①反应物投料比I_____II(填“>”或“<” 或“=”)。
②若按曲线II反应,n(CO)起始=10mol,反应物投料比=0.5,则A点的平衡常数(Ka)值为____,B点的平衡常数(Kb)值为________________。
(3)为提高CO的转化率,除了可以适当改变反应物与生成物的浓度外,还可以采取的措施有:________________、_______________。
查看答案和解析>>
科目:高中化学 来源:2017届江西省九江市十校高三第二次联考理科综合化学试卷(解析版) 题型:选择题
X、Y、Z、W为原子序数依次增加的四种短周期主族元素,且原子核外L电子层的电子数分别为4、6、8、8。Z元素原子核外K层与M层电子数相等。它们的最外层电子数之和为 18。下列说法中正确的是( )
A. W元素最高价氧化物对应的水化物化学式为H2WO3
B. 元素Y和W的非金属性强弱比较:Y<W
C. 原子半径由小到大的顺序为:Y<X<Z<W
D. X能分别与Y、W形成AB2型的化合物
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三实验班第六次月考理综化学试卷(解析版) 题型:填空题
工业生产中产生的SO2、NO直接排放将对大气造成严重污染.利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素).
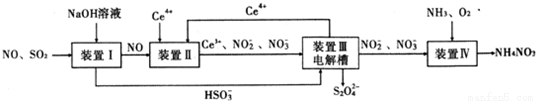
请回答下列问题.
(1)装置Ⅱ中NO在酸性条件下生成NO2-的离子方程式__________________;
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示
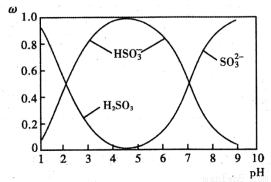
①下列说法正确的是 (填标号)。
A.pH=7时,溶液中c( Na+)<c (HSO3-)+c(SO32-)
B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7
C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜
D.pH=9时溶液中c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3)
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2,则反应的总离子方程式为 。
③取装置Ⅰ中的吸收液vmL,用cmol/L的酸性高锰酸钾溶液滴定。酸性高锰酸钾溶液应装在 (填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是 。
(3)装置Ⅲ 的作用之一是再生Ce4+ ,其原理如下图所示。
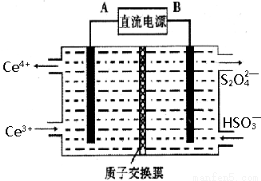
图中A为电源的 (填“正”或“负”)极。右侧反应室中发生的主要电极反应式为 。
(4) 已知进入装置Ⅳ的溶液中NO-2的浓度为 0.4 mol/L ,要使 1m3该溶液中的NO-2完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为 L。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一3月月考化学试卷(解析版) 题型:填空题
下表是元素周期表的一部分,按要求填空(均填元素符号或化学式):
周期 族 | IA | IIA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
4 | ⑩ |
(1)⑧位于元素周期表中第_______周期第_______ 族。
(2)在这些元素中,最活泼的非金属元素是______(填元素符号);元素的最高价氧化物对应水化物中,碱性最强的是______(填化学式)。
(3)④的单质和②的单质在点燃条件下生成物的电子式是_______;⑨的气态氢化物和溴化氢相比,较稳定的是___________(写化学式)。
(4)⑥与⑨形成的化合物和水反应,生成一种弱酸和一种强酸,该反应的化学方程式是_________________。
(5)元素①的气态氢化物与其最高价氧化物的水化物反应的化学方程式_________________。
(6)⑨的单质与⑩的最高价氧化物的水化物反应的离子方程式为___________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一3月月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数值,下列有关叙述正确的是( )
A. 标准状况下,2.24 LSO3含有的分子数为0.1NA。
B. 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA。
C. 1 molFe溶于过量硝酸,电子转移数为2NA。
D. 2.0gH218O与D2O的混合物中所含中子数为NA 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高一3月月考化学试卷(解析版) 题型:选择题
YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于 的说法正确的是( )
的说法正确的是( )
A. Y在周期表中的位置是第4周期IIIB族 B. 属于非金属元素
C. 核素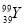 的质子数与中子数之差为50 D.
的质子数与中子数之差为50 D. 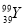 和
和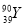 是两种不同的核素
是两种不同的核素
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省太原市高一3月阶段性测试化学试卷(解析版) 题型:选择题
下列关于碱金属的叙述中正确的是
A. 碱金属单质与水反应都能生成碱和H2
B. 碱金属单质都是质软、电和热的良导体,焰色反应都呈现黄色
C. 碱金属的密度都小于1g/cm3,因此碱金属单质都可以保存在煤油中
D. 碱金属单质在空气中燃烧都生成过氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com