

 $��_{��H+}^{��ŨKOH����}$
$��_{��H+}^{��ŨKOH����}$ +
+
 ��
�� ���÷�Ӧ�ķ�Ӧ���������۷�Ӧ��
���÷�Ӧ�ķ�Ӧ���������۷�Ӧ�� +4Ag��NH3��2++4OH-$\stackrel{��}{��}$
+4Ag��NH3��2++4OH-$\stackrel{��}{��}$ +2NH4++6NH3+4Ag��+2H2O��
+2NH4++6NH3+4Ag��+2H2O�� ������һ�֣�
������һ�֣� ��
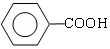
�� ���� A���巢��ȡ����Ӧ����B������B�Ľṹ��ʽ֪��AΪ�ڶ��ױ�����ṹ��ʽΪ ��A�����ڴ��������·���ȡ����Ӧ����C������C�ķ���ʽ֪��C�Ľṹ��ʽΪ
��A�����ڴ��������·���ȡ����Ӧ����C������C�ķ���ʽ֪��C�Ľṹ��ʽΪ ��B����һϵ�з�Ӧ�������ڱ�����ȩ�������֪��Ӧ��Ϣ��֪���ڱ�����ȩ��Ӧ����E��E�Ľṹ��ʽΪ
��B����һϵ�з�Ӧ�������ڱ�����ȩ�������֪��Ӧ��Ϣ��֪���ڱ�����ȩ��Ӧ����E��E�Ľṹ��ʽΪ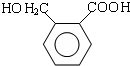 ��E�������۷�Ӧ����F����F�Ľṹ��ʽΪ
��E�������۷�Ӧ����F����F�Ľṹ��ʽΪ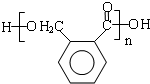 ��A�����Ը��������������D�������ᣬ��ṹ��ʽΪ
��A�����Ը��������������D�������ᣬ��ṹ��ʽΪ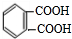 ���ڱ���������״�����������Ӧ������Ӧ�õ�D���ڱ�����������������ݴ˽��
���ڱ���������״�����������Ӧ������Ӧ�õ�D���ڱ�����������������ݴ˽��
��� �⣺A���巢��ȡ����Ӧ����B������B�Ľṹ��ʽ֪��AΪ�ڶ��ױ�����ṹ��ʽΪ ��A�����ڴ��������·���ȡ����Ӧ����C������C�ķ���ʽ֪��C�Ľṹ��ʽΪ
��A�����ڴ��������·���ȡ����Ӧ����C������C�ķ���ʽ֪��C�Ľṹ��ʽΪ ��B����һϵ�з�Ӧ�������ڱ�����ȩ�������֪��Ӧ��Ϣ��֪���ڱ�����ȩ��Ӧ����E��E�Ľṹ��ʽΪ
��B����һϵ�з�Ӧ�������ڱ�����ȩ�������֪��Ӧ��Ϣ��֪���ڱ�����ȩ��Ӧ����E��E�Ľṹ��ʽΪ ��E�������۷�Ӧ����F����F�Ľṹ��ʽΪ
��E�������۷�Ӧ����F����F�Ľṹ��ʽΪ ��A�����Ը��������������D�������ᣬ��ṹ��ʽΪ
��A�����Ը��������������D�������ᣬ��ṹ��ʽΪ ���ڱ���������״�����������Ӧ������Ӧ�õ�D���ڱ����������������
���ڱ���������״�����������Ӧ������Ӧ�õ�D���ڱ����������������
��1��AΪ ����ѧ�����ǣ��ڶ��ױ���
����ѧ�����ǣ��ڶ��ױ���
�ʴ�Ϊ���ڶ��ױ���
��2��������������֪��C�Ŀ��ܽṹ��ʽ�У� ��
��
�ʴ�Ϊ�� ��
��
��3��OPA�Ļ�ѧ�������ڱ�����ȩ��OPA���м���E�ɺϳ�һ�־�����߷��ӻ�����F���÷�Ӧ�Ļ�ѧ����ʽΪ ���÷�ӦΪ���۷�Ӧ��
���÷�ӦΪ���۷�Ӧ��
�ʴ�Ϊ�� �����۷�Ӧ��
�����۷�Ӧ��
��4��������Һ�����Ʒ�����ȡlmL2%����������Һ�ڽྻ���Թ��У�Ȼ�������ε���2%�İ�ˮ������������ij���ǡ���ܽ�Ϊֹ��OPA�����������Һ��Ӧ�����ӷ���ʽ +4Ag��NH3��2++4OH-$\stackrel{��}{��}$
+4Ag��NH3��2++4OH-$\stackrel{��}{��}$ +2NH4++6NH3+4Ag��+2H2O��
+2NH4++6NH3+4Ag��+2H2O��
�ʴ�Ϊ������������ˮ����������ij���ǡ���ܽ⣻ +4Ag��NH3��2++4OH-$\stackrel{��}{��}$
+4Ag��NH3��2++4OH-$\stackrel{��}{��}$ +2NH4++6NH3+4Ag��+2H2O��
+2NH4++6NH3+4Ag��+2H2O��
��5�����㻯����G��E�� ����ͬ���칹�壬G�����к���ȩ�����������ѻ����ֺ��������ţ�G���ܵĽṹ��ʽΪ
����ͬ���칹�壬G�����к���ȩ�����������ѻ����ֺ��������ţ�G���ܵĽṹ��ʽΪ  ��
��
�ʴ�Ϊ�� ������һ�֣�
������һ�֣�
��6���ڶ��ױ������Ը���������������ڱ������ᣬ��ṹ��ʽΪ ���Ա���������״�����������Ӧ������Ӧ�õ�D���ڱ�����������������ϳ�·��Ϊ��
���Ա���������״�����������Ӧ������Ӧ�õ�D���ڱ�����������������ϳ�·��Ϊ�� ��
��
�ʴ�Ϊ�� ��
��
���� ���⿼���л�����ƶϣ���ȷ�л���Ĺ����ż��������ǽⱾ��ؼ����Ѷ��еȣ���5����ͬ���칹�����дΪ�״��㡢�ѵ㣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������ˮ��Fe3+��NH4+��SO42-��OH- | |
| B�� | �������NaClO��Һ��Fe2+��H+��Cu2+��SO42- | |
| C�� | �������NaOH��Һ��Na+��AlO2-��SO42-��OH- | |
| D�� | �������NaHCO3��Һ��Na+��Al3+��SO42-��HCO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 CO2��������ɺϳ���ϩ��2CO2 ��g��+6H2��g��?C2H4��g��+4H2O��g����0.1MPaʱ����n��CO2����n��H2��=l��3Ͷ�ϣ���ò�ͬ�¶���ƽ��ʱ��ϵ�и�����Ũ�ȵĹ�ϵ��ͼ��������������ȷ���ǣ�������
CO2��������ɺϳ���ϩ��2CO2 ��g��+6H2��g��?C2H4��g��+4H2O��g����0.1MPaʱ����n��CO2����n��H2��=l��3Ͷ�ϣ���ò�ͬ�¶���ƽ��ʱ��ϵ�и�����Ũ�ȵĹ�ϵ��ͼ��������������ȷ���ǣ�������| A�� | �÷�Ӧ�ġ�H��O | |
| B�� | ����b����H2O | |
| C�� | N���M������״̬��c��H2����һ�� | |
| D�� | �����������䣬T1�桢0.2 MPa�·�Ӧ��ƽ��ʱc��H2����M��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ع��;����ӹ��������������Ʒ������������ | |
| B�� | PM2.5��������ֱ��ԼΪ2.5��10-6m����ɢ�ڿ������γ����ܽ� | |
| C�� | ��������TiO2�ⴥý�������ɽ�װ�������ͷŵ�HCHOת��Ϊ������ | |
| D�� | ����ʮһ�ŷɴ�����̫���ܵ�ذ�ɽ�����ת��Ϊ���ܣ�����ת�������ǹ辧�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 mol ICl����NaOH��Һ������NaC1��NaIOʱ��ת�Ƶĵ�����ΪNA | |
| B�� | �����£�1 L PH=2��HC1��Һ��1 L PH=1��CH3COOH��Һ��Ϻ����Һ����������������Ŀ����0.11NA | |
| C�� | �����£�����NA��NO2��N2O4���ӵĻ�����壬�¶Ƚ�����״���������ԼΪ22.4 L | |
| D�� | ���ﳣѹ�£�18g D2O������������Ϊ10NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| �������� | Fe��OH��3 | Fe��OH��2 | Ni��OH��2 |
| ��ʼ������pH | 1.1 | 6.5 | 7.1 |
| ������ȫ��pH | 3.2 | 9.7 | 9.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 28gN2����ԭ����ΪNA | B�� | 0.5molH2O����ԭ����Ϊ1.5NA | ||
| C�� | 1molH2O���е�ˮ������ĿΪNA | D�� | 0.5NACl2���ӵ����ʵ�����0.5mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ | B�� | ŨH2SO4 | C�� | ��ˮCaCl2 | D�� | ��ʯ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | PH3���ӳ������� | |
| B�� | PH3�����Ǽ��Է��� | |
| C�� | PH3��P ��ȡsp2�ӻ� | |
| D�� | PH3�����ȶ��Ե���NH3���ӣ���ΪN-H�����ܸ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com