
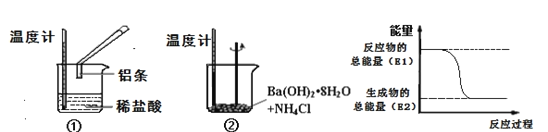
【题目】某实验小组同学进行如下实验,以检验化学反应中的能量变化。
(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是__热反应,Ba(OH)28H2O与NH4Cl反应时,需要将固体研细其目的是__,反应过程__(填“①”或“②”)的能量变化可用图表示。
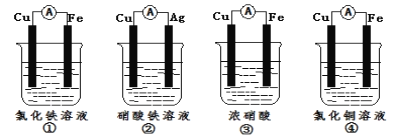
(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是__(填序号)。
【答案】放 增大接触面积,提高反应速率 ① ②
【解析】
(1)实验中发现,反应后①中的温度升高,说明铝与盐酸反应过程中释放能量使温度升高,则该反应为放热反应;②中的温度降低,说明Ba(OH)28H2O与NH4Cl反应过程中吸收能量使体系温度降低,为吸热反应,反应时将固体研细可以使固体反应物充分接触,有利于提高化学反应速率;由图中的物质的能量变化可知反应物的总能量高于产物的总能量,为放热反应,因此可以表示①的能量变化,故答案为:放;增大接触面积,提高反应速率;①。
(2)为了验证Fe3+与Cu2+氧化性强弱,应利用的反应原理是:Cu+2Fe3+=Cu2++2Fe2+;①中铁比铜活泼,铁做负极,反应原理为Fe+2Fe3+=3Fe2+,不能验证Fe3+与Cu2+氧化性强弱;②铜比银活泼,铜做负极,反应原理为Cu+2Fe3+=Cu2++2Fe2+,可验证Fe3+与Cu2+氧化性强弱;③铁遇到浓硝酸发生钝化,实际是铜做负极,反应原理是铜与浓硝酸的反应,不能验证Fe3+与Cu2+氧化性强弱;④铁比铜活泼,铁做负极,电解质溶液是氯化铜,反应原理是Cu2++Fe=Cu+Fe2+,不能验证Fe3+与Cu2+氧化性强弱;因此可以达到目的的是②,故答案为:②。


科目:高中化学 来源: 题型:
【题目】(1)下列说法正确的是___________
A.化学反应的实质就是旧化学键的断裂,新化学键的形成,在化学反应中,反应物转化为生成物的同时,必然伴随着能量的变化
B.钢铁生锈腐蚀时,铁被氧化
C.放热反应发生时,不一定要加热。但吸热反应必须要加热才能发生
(2)在 101 kPa 时,2g H2完全燃烧生成液态水,放出285.8kJ 热量,氢气燃烧的热化学方程式表示为___________________________;
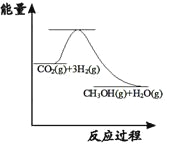
(3)目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)![]() CH3OH(g) +H2O(g);
CH3OH(g) +H2O(g);
下图表示该反应进行过程中能量的变化。(单位为:kJ·mol-1)该反应是___________(填“吸热”或“放热”)反应。ΔH__________0(填“>”或“<”)。
(4)比较下面各组热化学方程式,ΔH1<ΔH2的是________。
A.2H2(g)+O2(g)=2H2O(g)ΔH1;2H2(g)+O2(g)=2H2O(1)ΔH2
B.S(g)+O2(g)=SO2(g)ΔH1;S(s)+O2(g)=SO2(g)ΔH2
C.C(s)+1/2O2(g)=CO(g)ΔH1;C(s)+O2(g)=CO2(g)ΔH2
D.H2(g)+Cl2(g)=2HCl(g)ΔH1;1/2H2(g)+1/2Cl2(g)=HCl(g)ΔH2
(5)101 kPa条件下,14g N2和3g H2反应生成NH3的能量变化如下图示意:
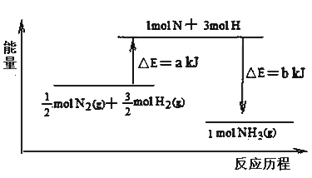
又已知:①已知b=1173;②25 ℃、101 kPa下N2(g)+3H2(g)![]() 2 NH3(g) ΔH =-92 kJ·mol-1则a =_________________。
2 NH3(g) ΔH =-92 kJ·mol-1则a =_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是课本“还原铁粉与水蒸气反应”的实验装置图。
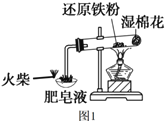
(1)铁粉与水蒸气反应的化学方程式是___。
(2)证明还原铁粉与水蒸气发生了反应的现象是___。
某同学设计图2装置进行“铁与水蒸气反应”的实验。(图中部分夹持及尾气处理装置略)
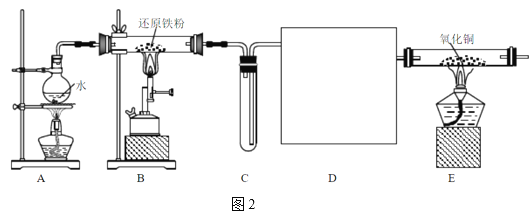
(3)图1装置中湿棉花的作用与图2中___(填“A、B、C、D、E”)装置的作用一样。
(4)装置D的作用是干燥氢气,请在方框内补充完整的装置和试剂___。
(5)实验结束,该同学取反应后装置B中固体混合物溶于足量稀硫酸,再向其中滴加几滴KSCN溶液,振荡,未见溶液变红,得出结论“反应后装置B中固体混合物”不含Fe3O4。你认为正确吗?为什么?你认为___,理由是___。
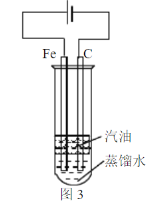
(6)某同学为实现“常温下铁与液态水的反应”设计了图3装置。实验中发现碳棒上冒气泡,蒸馏水中出现白色沉淀。书写该实验发生的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是人体健康必需的一种微量元素,已知Se的原子结构示意图如图:下列说法不正确的是

A. 该原子的质量数为34
B. 该元素处于第四周期第ⅥA族
C. SeO2既有氧化性又有还原性
D. 酸性:H2SO4>H2SeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前一个分散系中慢慢地滴入后一种分散系所观察到的现象不是先沉淀后变澄清的是( )
A.氢氧化铁胶体中滴加盐酸
B.四羟基合铝酸钠溶液中加盐酸
C.氯化铝溶液中滴加烧碱溶液
D.氯化铝溶液中滴加氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列五个转化,其中不能通过一步反应实现的是 ( )
①SiO2![]() Na2SiO3②CuSO4
Na2SiO3②CuSO4![]() CuCl2③SiO2
CuCl2③SiO2![]() H2SiO3④CuO
H2SiO3④CuO![]() Cu(OH)2
Cu(OH)2
⑤Na2O2![]() Na2SO4
Na2SO4
A.①②B.③④
C.②③④D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由两种或两种以上金属离子(或铵根离子)和一种酸根离子构成的盐称为复盐。为确定某复盐结晶水合物Q(含有两种金属阳离子)的组成,甲、乙两位同学分别进行了如下实验:
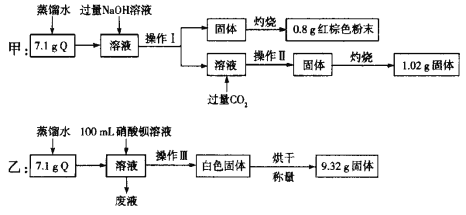
请回答下列问题:
(1)操作Ⅰ、Ⅱ、Ⅲ相同,为__________、洗涤,仅由甲的实验能不能确定操作Ⅰ中所得固体的成分?__________(填“能”或“不能”),说明理由:_________。
(2)甲实验中通入过量二氧化碳发生反应生成沉淀的离子方程式为_______。
(3)0.8 g红棕色粉末的物质的量为__________。
(4)乙实验中,若100 mL硝酸钡溶液恰好完全反应,则硝酸钡溶液的物质的量浓度为__________。
(5)Q的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素。碘元素以碘离子的形式存在。实验室从海藻中提取碘的流程如下:
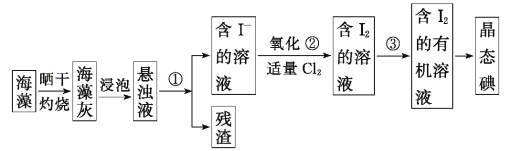
下列说法不正确的是
A.灼烧时用到的仪器有:酒精灯、玻璃棒、石棉网、烧杯
B.①、③两步实验操作分别为过滤和萃取
C.②反应的离子方程式为:Cl2 + 2I- = 2Cl- + I2
D.②中氧化剂也可用溴水代替
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com