
| A. | $\frac{m}{a}L$ | B. | $\frac{2m}{3a}L$ | C. | $\frac{m+n}{a}L$ | D. | $\frac{2(m+n)}{3a}L$ |
分析 NO单独不能被吸收,NO和NO2混合气体被NaOH溶液被完全吸收,由方程式可知满足n(NO2):n(NO)≥1,反应生成物有NaNO3、NaNO2,由化学式可知n(Na原子)=n(N原子),根据原子守恒计算n(NaOH),再根据c=$\frac{n}{V}$计算NaOH的物质的量浓度.
解答 解:反应生成物有NaNO3、NaNO2,由化学式可知n(Na原子)=n(N原子),由于恰好反应,根据原子守恒可知n(NaOH)=n(NO)+n(NO2)=(m+n)mol,
故此氢氧化钠溶液的物质的量浓度$\frac{(m+n)mol}{amol/L}$=$\frac{m+n}{a}$L,
故选C.
点评 本题考查混合物的有关计算,难度中等,根据原子守恒计算是关键,侧重对解题方法技巧与学生思维能力的考查.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时可用水扑灭 | |
| B. | 酒精灯着火时用湿抹布扑盖 | |
| C. | 蒸发结晶时,为得到更多晶体直接将溶液蒸干 | |
| D. | 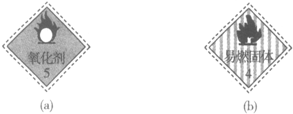 实验室可分别将贴有标志(a)和标志(b)的药品放在同一橱柜中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
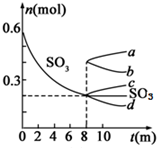 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T1℃时,在1L密闭容器中充入0.6molSO3,如图表示SO3物质的量随时间的变化曲线.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T1℃时,在1L密闭容器中充入0.6molSO3,如图表示SO3物质的量随时间的变化曲线.| T/℃ | T2 | T3 |
| K | 20.5 | 4.68 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
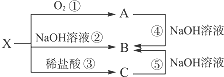 已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:
已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入Ba(NO3)2溶液中能生成BaSO4沉淀 | |
| B. | 在Si02+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2C0的反应中,Si02是氧化剂 | |
| C. | 生铁在潮湿的空气中主要发生析氢腐蚀 | |
| D. | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色气体,说明该钾盐是K2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
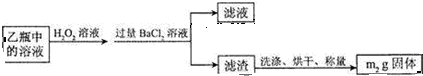
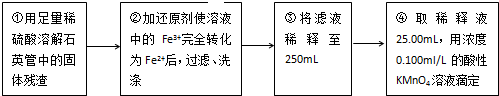
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com