
 X、Y、Z、R、Q为前四周期元素,且原子序数依次增大,其中Y原子核外2p能级上有1个电子,R原子L层上有2对成对电子,X与Z可形成共价化合物ZX3,Q原子在第四周期中未成对电子数最多.请回答下列问题:
X、Y、Z、R、Q为前四周期元素,且原子序数依次增大,其中Y原子核外2p能级上有1个电子,R原子L层上有2对成对电子,X与Z可形成共价化合物ZX3,Q原子在第四周期中未成对电子数最多.请回答下列问题:| 5+1 |
| 2 |
| ||
| 4 |
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||


科目:高中化学 来源: 题型:
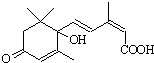 用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的结构如图,下列关于该物质的说法正确的是( )
用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的结构如图,下列关于该物质的说法正确的是( )| A、其分子中含有2个手性碳原子 |
| B、既能发生加聚反应,又能发生缩聚反应 |
| C、1 mol该物质与NaOH溶液反应,最多消耗2 mol NaOH |
| D、既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ag、Al、Cu、Fe |
| B、Al、Cu、Fe、Ag |
| C、Cu、Ag、Al、Fe |
| D、Fe、Cu、Al、Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaClO溶液中:c(Na+)=c(HClO)+c(ClO-) |
| B、等体积、等物质的量浓度的NaX和弱酸HX混合,所得溶液中:c(Na+)>c(X-)>c(H+)>c(OH-) |
| C、将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:c(NH4+)>c(Cl-)>c(NH3?H2O)>c(OH-)>c(H+) |
| D、将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) |
| B、Z在周期表中的位置为第3周期、IB族 |
| C、X的最高价氧化物对应水化物的酸性比W的弱 |
| D、W比Y更容易与氢气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、3:1 |
| C、3:5 | D、1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3+H+=NH4+ |
| B、HCO3-+OH-=H2O+CO32- |
| C、HCO3-+H2O?H2CO3+OH- |
| D、NH3?H2O?NH4++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子中共价键键角均为60° |
| B、黄砷中共价键键能大于白磷 |
| C、分子中含有的共价键的数目都是4 |
| D、黄砷的熔点低于白磷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com