
����Ŀ�������£�0.1 mol/L��H2C2O4��Һ��H2C2O4��HC2O4-��C2O42-��������ռ���ʵ����������ֲ�ϵ������pH�仯�Ĺ�ϵ��ͼ��ʾ�����б�������ȷ����( )

A.HC2O4-![]() H+��C2O42-��K��1��10-4.3
H+��C2O42-��K��1��10-4.3
B.�������ʵ�����NaHC2O4��Na2C2O4����ˮ�У�������ҺpHǡ��Ϊ4.3
C.������HF��K��1��10-3.45��������H2C2O4��Һ���뵽����NaF��Һ�У������ķ�ӦΪ��H2C2O4+F-=HF��HC2O4-
D.��0.1 mol/LNaHC2O4��Һ�У�������Ũ�ȴ�С��ϵΪ��c(Na+)��c(HC2O4-)��c(H+)��c(C2O42-)��c(OH-)
���𰸡�B
��������
A����HC2O4-![]() H++C2O42-����֪K=
H++C2O42-����֪K= 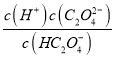 ��pH=4.3ʱ��c(C2O42-)=c(HC2O4-)������K=c(H+)=1��10-4.3����A��ȷ��
��pH=4.3ʱ��c(C2O42-)=c(HC2O4-)������K=c(H+)=1��10-4.3����A��ȷ��
B���������ʵ�����NaHC2O4��Na2C2O4����ˮ�У�HC2O4-����̶ȴ���C2O42-��ˮ��̶ȣ�������Һ��c(C2O42-)��c(HC2O4-)������ҺpH����4.3����B����
C��������H2C2O4��K1=10-1.3��K2=10-4.3��HF��KB=1��10-3.45�������ԣ�H2C2O4��HF��HC2O4-�����Խ�����H2C2O4��Һ���뵽����NaF��Һ�У������ķ�ӦΪH2C2O4+F-=HF+HC2O4-����C��ȷ��
D��NaHC2O4��Һ�����ԣ���HC2O4-�ĵ���Ϊ��������Һ�в��ֵ���HC2O4-���������Ũ�ȴ�С��ϵΪ��c(Na+)��c(HC2O4-)��c(C2O42-)��c(OH-)����D��ȷ��
�ʴ�ΪB��


 �»����ܶ�Ա��ϵ�д�
�»����ܶ�Ա��ϵ�д� ����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϡ����������(��C��)��ˮ������Ӧ��ȡH2��һ�ֵͺ��ܣ���Ч�ʵ���H2�������÷���������¯����H2��ȼ��¯����CaO�������ɡ�����¯���漰�ķ�Ӧ�У�
��.C(s)��H2O(g)![]() CO(g)��H2(g) K1��
CO(g)��H2(g) K1��
��.CO(g)��H2O(g)![]() CO2(g)��H2(g) K2��
CO2(g)��H2(g) K2��
��.CaO(s)��CO2(g)![]() CaCO3(s) K3��
CaCO3(s) K3��
ȼ��¯���漰�ķ�ӦΪ��
��.C(s)��O2(g)=CO2��
��.CaCO3(s)=CaO(s)��CO2(g)��
��1�����ܱ���Ϊ��߷�չDZ������ɫ��Դ���ù�����H2�ܷ�Ӧ�ɱ�ʾΪC(s)��2H2O(g)��CaO(s)![]() CaCO3(s)��2H2(g)���䷴Ӧ��ƽ�ⳣ��K=____(��K1��K2��K3�Ĵ���ʽ��ʾ)��
CaCO3(s)��2H2(g)���䷴Ӧ��ƽ�ⳣ��K=____(��K1��K2��K3�Ĵ���ʽ��ʾ)��
��2����һ�ݻ��ɱ���ܱ������н��з�Ӧ���º�ѹ�����£������м���1.0mol̿��1.0molˮ�������ﵽƽ��ʱ�������������Ϊԭ����1.25����ƽ��ʱˮ������ƽ��ת����Ϊ_____����������в���amol̿��ˮ������ת���ʽ�_____������������������С����������������
��3�����ڷ�Ӧ����ƽ��ʱ�ٳ���CO2��ʹ��Ũ������ԭ����2������ƽ��_____�ƶ�( ����������������������������)��������ƽ���CO2Ũ��___(���������������С������������)��
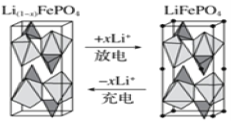
��4��һ����������Ӷ��ε�������������(LiFePO4)��ء���Ϊ�������ϵ���������ڳ䡢�ŵ�ʱ�ľֲ��Ŵ�ʾ��ͼ��ͼ��д���õ�س��ʱ�������缫��Ӧʽ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����ͬŨ�ȵ�NaOH��Һ���ֱ�ζ�Ũ�Ⱦ�Ϊ0.1mol��L��1��������(HA��HB��HD)��Һ���ζ���������ͼ��ʾ�������жϴ������( )

A. ������ĵ��볣����ϵ��KHA��KHB��KHD
B. �ζ���P��ʱ����Һ�У�c(B��)��c(Na��)��c(HB)��c(H��)��c(OH��)
C. pH=7ʱ��������Һ�У�c(A��)=c(B��)=c(D��)
D. ���кͰٷ�����100%ʱ����������Һ��Ϻ�c(HA)��c(HB)��c(HD)=c(OH��)��c(H��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���2L���ܱ������У�����1molX��g����2molY��g��������Ӧ��X��g��+m Y��g��![]() 3Z��g����ƽ��ʱ��X��Y��Z����������ֱ�Ϊ30%��60%��10%���ڴ�ƽ����ϵ�м���1molZ��g�����ٴδﵽƽ���X��Y��Z������������䡣������������ȷ����
3Z��g����ƽ��ʱ��X��Y��Z����������ֱ�Ϊ30%��60%��10%���ڴ�ƽ����ϵ�м���1molZ��g�����ٴδﵽƽ���X��Y��Z������������䡣������������ȷ����
A. m=2
B. ����ƽ���ƽ�ⳣ����ͬ
C. X��Y��ƽ��ת����֮��Ϊ1:1
D. �ڶ���ƽ��ʱ��Z��Ũ��Ϊ0.4 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��t ��ʱAg2CrO4��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵����ȷ����
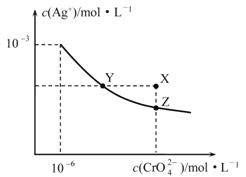
A.��t ��ʱ��Ag2CrO4��Ksp��1��10��9
B.X����Ag2CrO4��������
C.ͨ��������������ʹ��Һ��Y��䵽Z��
D.�ڱ���Ag2CrO4��Һ�м���K2CrO4����ʹ��Һ��Y��䵽X�����ձ䵽Z��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z��ԭ���������ε�����a��b��c��d��e��f������ЩԪ����ɵĻ����mΪ���ʣ�d�ǵ���ɫ��ĩ��b�������г�����Һ̬������������ʵ�ת����ϵ��ͼ��ʾ������˵����ȷ����
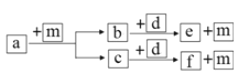
A. ������a��ֻ����C��H����Ԫ��
B. ����Ԫ�ص�ԭ�Ӱ뾶�ɴ�С˳��ΪZ��Y��X��W
C. d�����ӻ�����������Ӹ�����Ϊ1��2
D. Y��W�γɵļ�������ͬ����Ԫ��ͬ���ͻ������зе���͵�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��25 ��ʱ��CH3COOH��NH3��H2O�ĵ��볣����ȡ�
��1��25 ��ʱ��ȡ10 mL 0.1 mol��L-1������Һ�����pH��3������Һ��ˮϡ����100 mL����ҺpH��ֵ��ΧΪ___________����Һ��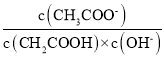 ____����������������С������������������ȷ��������
____����������������С������������������ȷ��������
��2��25 ��ʱ��0.1 mol��L-1��ˮ��NH3��H2O��Һ����pH��______��
��3��ij�¶��£���V1mL 0.1 mol��L-1NaOH��Һ����μ����Ũ�ȵĴ�����Һ����Һ��pOH��pH�ı仯��ϵ��ͼ����֪��pOH��- lgc(OH-)��ͼ��M��Q��N������ʾ��Һ��ˮ�ĵ���̶����ĵ���___________��
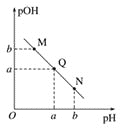
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӣ�Ni��Cd���ɳ�������ִ��������й㷺Ӧ�á���֪ij���ӵ�صĵ������ҺΪKOH��Һ����䡢�ŵ簴��ʽ���У�Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2���йظõ�ص�˵����ȷ����
Cd(OH)2 + 2Ni(OH)2���йظõ�ص�˵����ȷ����
A�����ʱ������Ӧ��Ni(OH)2 ��e�� + OH- = NiOOH + H2O
B���������ǻ�ѧ��ת��Ϊ���ܵĹ���
C���ŵ�ʱ����������Һ�ļ��Բ���
D���ŵ�ʱ�������Һ�е�OH-�������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������£���CH3COONaϡ��Һ�зֱ���������������ʣ�
������NaOH��������KOH��������NaHSO4��������CH3COONa����������
����һ����ʹc��CH3COO-��/c��Na+����ֵ������� (����)
A. �٢� B. �ڢ� C. �٢� D. �ڢܢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com