
【题目】(1)同温同压下,有两瓶体积相等的CO和CO2,这两种气体中所含的分子数目之比为___,质量比为________。
(2)在Cu + 2H2SO4(浓) ![]() CuSO4+ SO2↑+ 2H2O反应中,
CuSO4+ SO2↑+ 2H2O反应中,
①________是氧化剂。
②用双线桥标出该反应电子转移的方向和数目。_________________
Cu + 2H2SO4(浓) ![]() CuSO4+ SO2↑+ 2H2O
CuSO4+ SO2↑+ 2H2O
③若有2.4mol的H2SO4参与反应,生成标况下的二氧化硫气体_______ L,转移电子的数目为_______________。(NA表示阿伏加德罗常数的值)
【答案】 1:1 7:11 浓硫酸 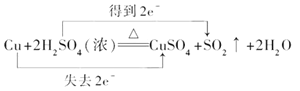 26.88L 2.4NA(或者1.4448×1024)
26.88L 2.4NA(或者1.4448×1024)
【解析】(1)同温同压下,相同体积的任何气体具有相同数目的分子;因此两瓶体积相等的CO和CO2,气体的物质的量相等,物质的量之比等于气体的分子数之比,因此两种气体中所含的分子数目之比为1:1;由于气体的物质的量相等,所以气体质量之比等于气体摩尔质量之比:28:44=7:11;正确选项:1:1; 7:11。
(2)①Cu + 2H2SO4(浓) ![]() CuSO4+ SO2↑+ 2H2O中,铜元素的化合价由0价→+2价,失电子被氧化,硫元素的化合价由+6价→+4价,所以硫酸得电子作氧化剂,浓硫酸做氧化剂;正确答案:浓硫酸。
CuSO4+ SO2↑+ 2H2O中,铜元素的化合价由0价→+2价,失电子被氧化,硫元素的化合价由+6价→+4价,所以硫酸得电子作氧化剂,浓硫酸做氧化剂;正确答案:浓硫酸。
②铜失电子数:2-0=2,硫酸得电子数:6-4=2,该反应中转移电子数是2,用双线桥标出该反应电子转移的方向和数目为: 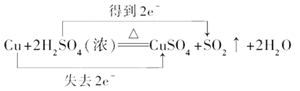 ,正确答案
,正确答案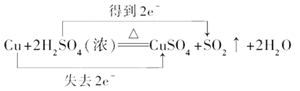 。
。
③该反应中有一半的硫酸是氧化剂,一半的硫酸起酸的作用,所以若有![]() 的
的![]() 参与反应,则被还原的
参与反应,则被还原的![]() 的物质的量是
的物质的量是![]() ,由此可以知道生成标况下的二氧化硫气体的体积为
,由此可以知道生成标况下的二氧化硫气体的体积为![]() ;该反应转移电子2mol电子,消耗浓硫酸2mol,现
;该反应转移电子2mol电子,消耗浓硫酸2mol,现![]() 的
的![]() 参与反应,转移电子2.4 mol,电子的数目为2.4NA 或1.4448×1024;正确答案:26.88L; 2.4NA (或者1.4448×1024)。
参与反应,转移电子2.4 mol,电子的数目为2.4NA 或1.4448×1024;正确答案:26.88L; 2.4NA (或者1.4448×1024)。


科目:高中化学 来源: 题型:
【题目】除去下列物质中的杂质,所用试剂和方法正确的是( )
选项 | 物质 | 杂质 | 除杂质所用试剂和方法 |
A | KCl溶液 | I2 | 蒸馏 |
B | KNO3 | K2SO4 | BaCl2溶液,过滤 |
C | Cu | CuO | 稀硫酸,过滤 |
D | CaCO3 | Ca(OH)2 | 盐酸,过滤 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋动物海鞘中含有种类丰富、结构新颖的次生代谢产物,是海洋抗肿瘤活性物质的重要来源之一。一种从海鞘中提取具有抗肿瘤活性的天然产物的流程如下:
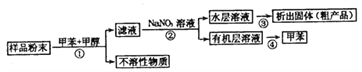
下列关于该流程中各步骤的说法中,错误的是( )
选项 | 步骤 | 采用装置 | 主要仪器 |
A | ① | 过滤装置 | 漏斗 |
B | ② | 分液装置 | 分液漏斗 |
C | ③ | 蒸发装置 | 坩埚 |
D | ④ | 蒸馏装置 | 蒸馏烧瓶 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂)。其制备装置及步骤如下:
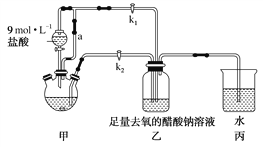
①检查装置气密性,往三颈烧瓶中依次加入过量锌粉、适量CrCl3溶液。
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到2.76 g[Cr(CH3COO)2]2·2H2O。
(1)装置甲中连通管a的作用是______________________。
(2)三颈烧瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为______________________。
(3)实验步骤③中溶液自动转移至装置乙中的实验操作为______________________。
(4)装置丙中导管口水封的目的是______________________。
(5)洗涤产品时,为了去除可溶性杂质和水分,下列试剂的正确使用顺序是________(填字母)。
a.乙醚 b.去氧冷的蒸馏水 c.无水乙醇
(6)若实验所取用的CrCl3溶液中含溶质3.17 g,则[Cr(CH3COO)2]2·2H2O(相对分子质量为376)的产率是______________________。
(7)一定条件下,[Cr(CH3COO)2]2·2H2O受热得到CO和CO2的混合气体,请设计实验检验这两种气体的存在________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关氯水的说法正确的是( )
A.能使湿润的有色布条褪色,说明氯水中有Cl2
B.溶液呈黄绿色,有刺激性气味,说明氯水中有Cl2
C.加入盐酸酸化的BaCl2溶液产生白色沉淀,说明氯水中有Cl-
D.加入NaOH溶液,黄绿色消失,说明氯水中有HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图各装置进行实验能成功完成相应实验的是
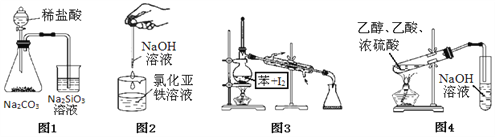
A. 图1:证明非金属性强弱:C>Si B. 图2:制备氢氧化亚铁
C. 图3:分离碘并回收苯 D. 图4:制取和收集乙酸乙酯
【答案】C
【解析】A、稀盐酸易有挥发性,反应产生的二氧化碳中含有氯化氢,能使硅酸钠反应生成硅酸沉淀的不一定是碳酸,故无法证明非金属性C>Si,选项A错误;B、为防止制得的的氢氧化亚铁被氧化,必须将滴管插到液面以下或在液面上加苯覆盖以防止空气中氧气进入溶液氧化产生的氧化亚铁,选项B错误;C、碘溶于苯中,利用沸点的不同蒸馏使苯分离出来并回收苯,实验装置及操作正确,选项C正确;D、制取和收集乙酸乙酯时必须用饱和碳酸钠溶液吸收乙酸乙酯而不能用氢氧化钠溶液,选项D错误。答案选C。
【题型】单选题
【结束】
5
【题目】A、B、C、D、E、F是原子序数依次增大的短周期主族元素。E是同周期元素金属性最强的元素。甲、乙、丙、丁、戊是由上述部分元素中的两种或几种组成的化合物,它们的转化关系如图所示。其中甲是生活中的调味品,丁是淡黄色固体。下列说法不正确的是
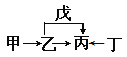
A. 原子半径由大到小的顺序为:r(E)>r(F)>r(C)>r(D)
B. 元素F的氧化物的水物化的酸性一定比硫酸酸性强
C. 元素B的氢化物可能具有正四面体结构
D. 化合物A4BC2D既可能是共价化合物,也可是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中一定属于吸热反应的是( )
A.需加热或点燃才能引发的反应
B.氧化还原反应
C.氢氧化钡晶体和氯化铵晶体混合搅拌
D.一氧化碳和氧气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向偏铝酸钠溶液中逐滴加入盐酸,溶被的pH值随着加入盐酸体积的变化曲线如图所示,则下列说法正确的是
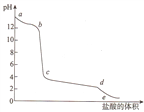
A. a~b段的主要离子方程式为A102-+4H+=Al3++2H2O
B. 向c点溶液中滴加氨水,发生的离子方程式为A13++30H-=Al(OH)3↓
C. c~d段的主要离子方程式为Al(OH)3+3H+= A13++3H2O
D. 向c点溶液中加入碳酸钠,发生的离子方程式为2 A13++CO32-+3H2O =2Al(OH)3↓+CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com