
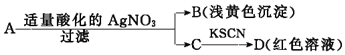
| A. | D溶液中存在Fe(SCN)3 | B. | 滤液C中有Fe3+ | ||
| C. | B为AgBr | D. | A一定是FeBr2 |
分析 A中加入硝酸银生成浅黄色沉淀,为AgBr,应含有Br元素,C中滴加KSCN变红色,说明含有Fe元素,因硝酸根离子在酸性条件下具有强氧化性,不能确定A中是否含有Fe3+,可能含有Fe2+,以此解答该题.
解答 解:A中加入硝酸银生成浅黄色沉淀,B为AgBr,应含有Br元素,C中滴加KSCN变红色,说明含有Fe元素,滤液C中有Fe3+,D溶液中存在Fe(SCN)3,因硝酸根离子在酸性条件下具有强氧化性,不能确定A中是否含有Fe3+,可能含有Fe2+,
故选D.
点评 本题考查物质的检验和鉴别,为高频考点,侧重考查学生的分析能力和实验能力,注意把握物质的性质,难度不大,注意实验的严密性和可行性的评价.


科目:高中化学 来源: 题型:选择题
| A. | 两容器内压强一定相等 | B. | 两容器中A的浓度一定相等 | ||
| C. | 两容器吸收或放出的热量一定相等 | D. | 两容器中B的百分含量一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(l-) | amol | 0mol | 0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
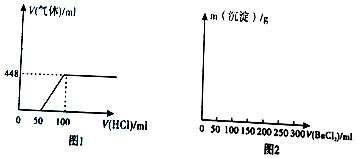
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有元素原子的最外层电子数都等于元素的最高化合价 | |
| B. | P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次减弱 | |
| C. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| D. | 熔融状态能导电的化合物一定含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+Cl2(g)═2HCl(g)△H=-184.6 kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3 kJ/mol | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | C(s)+O2(g)═CO2(g)△H=-285.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
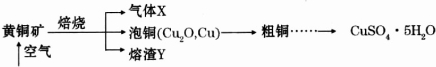
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com