
分析 ①速率之比等于对应物质的化学计量数之比;
②0到2s用物质B来表示的反应速率为$\frac{\frac{0.2mol}{2L}}{2s}$=0.05 mol/(L•s);
③物质的转化率(%)=$\frac{反应物转化的物质的量}{反应物起始的物质的量}$×100%;
④根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①速率之比等于对应物质的化学计量数之比,所以a:b:c=0.6:0.2:0.4,而c=2,则a=3,b=1,所以化学方程式为:3A (g)+B (g)?2C(g),
故答案为:3A (g)+B (g)?2C(g);
②0到2s用物质B来表示的反应速率为$\frac{\frac{0.2mol}{2L}}{2s}$=0.05 mol/(L•s),故答案为:0.05 mol/(L•s);
③物质的转化率(%)=$\frac{反应物转化的物质的量}{反应物起始的物质的量}$×100%=$\frac{0.6}{1.5}×100%$=40%,故答案为:40%;
④A.vB(反应)=vC(生成),不等于计量数之比,故A错误;
B.容器内气体的总压强保持不变,说明气体的物质的量相等,反应达平衡状态,故B正确;
C.容器内气体的密度一直不变,故C错误;
D.只要反应发生vA:vB:vC=3:1:2,故D错误;
E.容器内气体C的物质的量分数保持不变,说明各组分的物质的量不变,反应达平衡状态,故E正确;
故选BE.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


科目:高中化学 来源: 题型:选择题
| A. | 0.4mol H2 | B. | 8.8g CO2 | ||
| C. | 6.02×1022个CH4 | D. | 4.48L NH3(标准状况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | G+H=W,其它条件相同时,分别在200℃和100℃下进行反应 | |
| B. | 相同温度下,颗粒相同的锌粒分别与H+浓度相同的硫酸和盐酸反应 | |
| C. | A+B=C(500℃下进行) D+E=F(100℃下进行) | |
| D. | 相同温度下,锌粒与铁粉分别与同浓度的盐酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②④⑤ | B. | 全部 | C. | 只有①② | D. | 只有①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔)$\frac{\underline{\;电解\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔)$\frac{\underline{\;电解\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )| A. | 电解熔融氢氧化钠制钠,阳极发生电解反应2OH--2e-═H2↑+O2↑ | |
| B. | 盖•吕萨克法制钠原理是利用铁的还原性比钠强 | |
| C. | 若戴维法与盖•吕萨克法制得等量的钠,则两反应中转移的电子总数不同 | |
| D. | 目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨极为阴极,铁为阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成单质分子的粒子一定含共价键 | |
| B. | 非金属元素组成的化合物一定不是离子化合物 | |
| C. | 第ⅠA族和第ⅦA族原子化合时一定形成离子键 | |
| D. | 共价化合物中一定不含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol的羟基与1mol的氢氧根离子所含电子数均为9NA | |
| B. | 500mL0.1mol/L盐酸中,含有HCl分子数目为0.05NA | |
| C. | 1molNa被氧化生成NaNO3水溶液或NaCl,都失去NA个电子 | |
| D. | 1.0L1.0mol•L-1的NaNO3水溶液中含有的氧原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
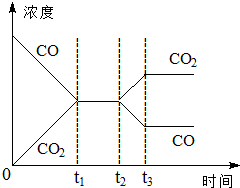 在一个恒容反应器中发生反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的平衡常数随温度的变化如表:
在一个恒容反应器中发生反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的平衡常数随温度的变化如表:| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com