
”¾ĢāÄæ”æ³ÉŹģµÄĘ»¹ūÖŠŗ¬ÓŠµķ·Ū”¢ĘĻĢŃĢĒŗĶĪŽ»śŃĪµČ£¬Ä³æĪĶāŠĖȤŠ”×éÉč¼ĘĮĖŅ»×鏵ŃéÖ¤Ć÷ijŠ©³É·ÖµÄ“ęŌŚ£¬ĒėÄć²ĪÓė²¢ŠÖśĖūĆĒĶź³ÉĻą¹ŲŹµŃ锣
£Ø1£©Č”ÉŁĮæĘ»¹ūÖ£¬¼ÓČėµāĖ®£¬ČÜŅŗ±äĄ¶£¬ŌņĘ»¹ūÖŠŗ¬ÓŠ______________”£
£Ø2£©Č”ÉŁĮæĘ»¹ūÖ£¬¼ÓČėŠĀÖĘCu(OH)2²¢¼ÓČČ£¬²śÉśŗģÉ«³Įµķ£¬ŌņĘ»¹ūÖŠŗ¬ÓŠ_____________”£
£Ø3£©ĘĻĢŃĢĒŌŚŅ»¶ØĢõ¼žĻĀæÉŅŌµĆµ½ŅŅ“¼”£Š“³öŅŅ“¼ÓėŅŅĖį·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ_____________”£ĻĀĮŠĪļÖŹÖŠæÉŅŌ¼ų±šŅŅĖįŗĶŅŅ“¼µÄŹĒ_________£ØĢī×ÖÄø£©”£
A.Ģ¼ĖįÄĘČÜŅŗ B.Ė® C.×ĻÉ«ŹÆČļŹŌŅŗ
”¾“š°ø”æµķ·Ū ĘĻĢŃĢĒ ![]() AC
AC
”¾½āĪö”æ
£Ø1£©µķ·ŪÓöµā±äĄ¶É«£»
£Ø2£©ĘĻĢŃĢĒŗ¬ÓŠČ©»ł£¬ÄÜ»¹ŌŠĀÖʵÄĒāŃõ»ÆĶµĆµ½×©ŗģÉ«µÄŃõ»ÆŃĒĶ³Įµķ£»
£Ø3£©ŅŅ“¼ŗĶŅŅĖį·¢ÉśČ”“ś·“Ó¦£¬ŹĒŅŅ“¼·Ö×ÓĄļōĒ»łÉĻµÄĒāŌ×Ó±»ŅŅĖį·Ö×ÓÖŠµÄŅŅõ£»łĖł“śĢę£»ŅŅĖįČÜŅŗĻŌĖįŠŌ£¬Äܹ»Ź¹ÖøŹ¾¼Į±äÉ«£¬Äܹ»ÓėĢ¼ĖįÄĘČÜŅŗ·“Ó¦£¬¶ųŅŅ“¼²»ÄÜ”£
£Ø1£©Č”ÉŁĮæĘ»¹ūÖ£¬¼ÓČėµāĖ®£¬ČÜŅŗ±äĄ¶£¬µķ·ŪÓöµā±äĄ¶É«£¬ĖµĆ÷Ę»¹ūÖÖŠŗ¬ÓŠµķ·Ū£¬¹Ź“š°øĪŖ£ŗµķ·Ū£»
£Ø2£©Ę»¹ūÖŗ¬ÓŠĘĻĢŃĢĒ£¬ĘĻĢŃĢĒÄܹ»ŗĶŠĀÖʵÄĒāŃõ»ÆĶ·“Ӧɜ³ÉשŗģÉ«³ĮµķCu2O£¬¹Ź“š°øĪŖ£ŗĘĻĢŃĢĒ£»
£Ø3£©AĪŖŅŅ“¼£¬ŅŅ“¼ÓėCH3COOH·“Ó¦£¬ĖįĶŃōĒ»ł“¼ĶŃĒā£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖCH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O£¬øĆ·“Ó¦ĪŖČ”“ś·“Ó¦£¬¹Ź“š°øĪŖ£ŗCH3CH2OH+CH3COOH
CH3COOCH2CH3+H2O£¬øĆ·“Ó¦ĪŖČ”“ś·“Ó¦£¬¹Ź“š°øĪŖ£ŗCH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O£»
CH3COOCH2CH3+H2O£»
ŅŅĖįÓėĢ¼ĖįÄĘČÜŅŗ·“Ӧɜ³É¶žŃõ»ÆĢ¼ĘųĢ壬¶ųŅŅ“¼²»ÄÜ£¬ĻÖĻó²»Ķ¬£¬æɼų±š£¬AÕżČ·£»ŅŅĖįŗĶŅŅ“¼¾łČÜÓŚĖ®£¬²»·Ö²ć£¬²»Äܼų±š£¬¹ŹB“ķĪó£»ŅŅĖįÓöŹÆČļ±äŗģ£¬¶ųŅŅ“¼²»ÄÜ£¬ĻÖĻó²»Ķ¬£¬æɼų±š£¬¹ŹCÕżČ·£¬¹ŹŃ”AC£¬¹Ź“š°øĪŖ£ŗAC”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĶ¬Ń§ÓĆĻĀĮŠ×°ÖĆ½ųŠŠÓŠ¹ŲCl2µÄŹµŃ锣ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ


A. ¢ńĶ¼ÖŠ£ŗŹµŃéĻÖĻóÖ¤Ć÷ĀČĘųĪŽĘÆ°××÷ÓĆ£¬ĀČĖ®ÓŠĘÆ°××÷ÓĆ
B. ¢ņĶ¼ÖŠ£ŗĪÅCl2µÄĘųĪ¶
C. ¢óĶ¼ÖŠ£ŗÉś³É×Ų»ĘÉ«µÄŃĢ
D. ¢ōĶ¼ÖŠ£ŗČōĘųĒņøɱń£¬Ö¤Ć÷Cl2æÉÓėNaOH·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪŖĮĖ²ā¶ØŹµŃéŹŅ³¤ĘŚ“ę·ÅµÄNa2SO3¹ĢĢåµÄ“æ¶Č£¬×¼Č·³ĘČ”w g¹ĢĢåѳʷ£¬Åä³É250 mLČÜŅŗ”£Éč¼ĘĮĖŅŌĻĀĮ½ÖÖŹµŃé·½°ø£ŗ
·½°øI£ŗČ”25.00 mLÉĻŹöČÜŅŗ”ś¼ÓČė×ćĮæµÄŃĪĖįĖį»ÆµÄBaCl2ČÜŅŗ”ś²Ł×÷I”śĻ“µÓ”ś²Ł×÷¢ņ”ś³ĘĮ棬µĆµ½³ĮµķµÄÖŹĮæĪŖm1 g
·½°ø¢ņ£ŗČ”25.00 mLÉĻŹöČÜŅŗ£¬ÓĆa mol/L µÄĖįŠŌKMnO4ČÜŅŗ½ųŠŠµĪ¶Ø”£(5SO32-+2MnO4-+6H+=5SO42-+2Mn2++3H2O)
µĪ¶Ø“ĪŹżŹµŃ鏿¾Ż | 1 | 2 | 3 | 4 |
“ż²āČÜŅŗĢå»ż/mL | 25.00 | 25.00 | 25.00 | 25.00 |
µĪ¶Ø¹Ü³õ¶ĮŹż/mL | 0.00 | 0.20 | 0.10 | 0.15 |
µĪ¶Ø¹ÜÄ©¶ĮŹż/mL | 19.95 | 20.20 | 19.15 | 20.20 |
ŹµŃéÖŠĖł¼ĒĀ¼µÄŹż¾ŻČēĻĀ±ķ£ŗ
£Ø1£©ÅäÖĘ250 mL Na2SO3ČÜŅŗŹ±£¬±ŲŠėÓƵ½µÄŹµŃéŅĒĘ÷ÓŠ£ŗÉÕ±”¢²£Į§°ō”¢½ŗĶ·µĪ¹Ü”¢ĮæĶ²”¢Ņ©³×ŗĶ_________”¢____________”£
£Ø2£©²Ł×÷IĪŖ________²Ł×÷¢ņĪŖ____________
£Ø3£©·½°øIÖŠČēŗĪÅŠ¶Ļ¼ÓČėµÄĀČ»Æ±µŅŃ¾¹żĮæ_____________£¬ŌŚ·½°ø¢ņÖŠµĪ¶ØÖÕµćµÄÅŠ¶Ļ·½·ØŹĒ________________”£
£Ø4£©øł¾Ż·½°ø¢ņĖłĢį¹©µÄŹż¾Ż£¬¼ĘĖćNa2SO3µÄ“æ¶ČĪŖ_________”£
£Ø5£©ÉĻŹöŹµŃéÖŠ£¬ÓÉÓŚ²Ł×÷“ķĪóĖłŅżĘšµÄĪó²ī·ÖĪöÕżČ·µÄŹĒ_________
A.·½°øIÖŠČōƻӊĻ“µÓ²Ł×÷£¬ŹµŃé½į¹ū½«Ę«Š”
B.·½°øIÖŠČōƻӊ²Ł×÷¢ņ£¬ŹµŃé½į¹ū½«Ę«“ó
C.·½°ø¢ņÖŠ£¬µĪ¶Ø¹ÜŌŚµĪ¶ØĒ°ĪŽĘųÅŻ£¬µĪ¶Øŗó³öĻÖĘųÅŻ£¬ŹµŃé½į¹ūĘ«Š”
D.·½°ø¢ņÖŠ£¬µĪ¶ØÖÕµćŹ±ŃöŹÓ¶ĮŹż£¬ŹµŃé½į¹ūĘ«“ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĄūÓĆ·“Ó¦6NO2£«8NH3===7N2£«12H2O¹¹³Éµē³ŲµÄ×°ÖĆČēĶ¼ĖłŹ¾”£“Ė·½·Ø¼ČÄÜŹµĻÖÓŠŠ§Ēå³żµŖŃõ»ÆĪļµÄÅÅ·Å£¬¼õĒį»·¾³ĪŪČ¾£¬ÓÖÄܳä·ÖĄūÓĆ»ÆѧÄÜ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø£©

A. µēĮ÷“Ó×ó²ąµē¼«¾¹żøŗŌŲŗóĮ÷ĻņÓŅ²ąµē¼«
B. ĪŖŹ¹µē³Ų³ÖŠų·Åµē£¬Ąė×Ó½»»»Ä¤ŠčŃ”ÓĆŅõĄė×Ó½»»»Ä¤
C. µē¼«A¼«·“Ó¦Ź½ĪŖ2NH3£6e£===N2£«6H£«
D. µ±ÓŠ4.48 L NO2±»“¦ĄķŹ±£¬×ŖŅʵē×ÓŹżĪŖ0.8NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ŌÓŚZn£«H2SO4”śZnSO4£«H2”ü£«QµÄ»Æѧ·“Ó¦£¬ĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ
A.·“Ó¦¹ż³ĢÖŠÄÜĮæ¹ŲĻµČēĶ¼ĖłŹ¾
B.QµÄÖµÓė·“Ó¦µÄ¼ĘĮæĻµŹżÓŠ¹Ų
C.Čō½«·“Ó¦Éč¼Ę³ÉŌµē³ŲŠæĪŖøŗ¼«
D.Čō½«ĘäÉč¼ĘĪŖŌµē³Ų£¬µ±ÓŠ32.5gŠæČܽā£¬Õż¼«·Å³öµÄĘųĢåŅ»¶ØĪŖ11.2L
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
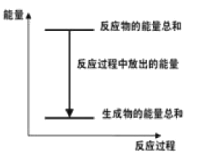
”¾ĢāÄæ”æ·“Ó¦mA(s)+nB(g) ![]() eC(g)+fD(g)£¬”÷H=Q £¬·“Ó¦¹ż³ĢÖŠ£¬µ±ĘäĖüĢõ¼ž²»±äŹ±£¬CµÄ°Ł·Öŗ¬Įæ£ØC%£©ÓėĪĀ¶Č£ØT£©ŗĶŃ¹Ēæ£ØP£©µÄ¹ŲĻµČēĶ¼£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ
eC(g)+fD(g)£¬”÷H=Q £¬·“Ó¦¹ż³ĢÖŠ£¬µ±ĘäĖüĢõ¼ž²»±äŹ±£¬CµÄ°Ł·Öŗ¬Įæ£ØC%£©ÓėĪĀ¶Č£ØT£©ŗĶŃ¹Ēæ£ØP£©µÄ¹ŲĻµČēĶ¼£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ

A. “ļµ½Ę½ŗāŗó£¬ČōÉżĪĀ£¬Ę½ŗāÕżŅĘ
B. »Æѧ·½³ĢŹ½ÖŠm+n>e+f
C. µ½Ę½ŗāŗ󣬼ÓČė“߻ƼĮøĆ·“Ó¦”÷H¼õŠ”
D. “ļµ½Ę½ŗāŗ󣬳äČėŅ»¶ØĮæC£¬Ę½ŗā³£Źż²»±ä
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ±½¼×Ėį(C6 H 5COOH)ŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬¹ć·ŗÓ¦ÓĆÓŚÖĘŅ©ŗĶ»Æ¹¤ŠŠŅµ”£Ä³»ÆѧŠ”×éÓĆ¼×±½×÷Ö÷ŅŖŌĮĻÖʱø±½¼×ĖįµÄ²½ÖčČēĻĀ£ŗ
²½ÖčŅ»£ŗŌŚČēĶ¼¼×ĖłŹ¾×°ÖƵÄČż¾±ĘæÖŠ¼ÓČė2.7mL¼×±½(2.3g)”¢100mLĖ®ŗĶ2”«3ʬĖé“Éʬ£¬æŖ¶Æµē¶Æ½Į°čĘ÷£¬aÖŠĶØČėĮ÷¶ÆµÄĖ®£¬ŌŚŹÆĆŽĶųÉĻ¼ÓČČÖĮ·ŠĢŚ£¬Č»ŗó·ÖÅś¼ÓČĖ8.5gøßĆĢĖį¼Ų£¬ŌŚ100”ꏱ£¬¼ĢŠų½Į°čŌ¼4~5h£¬ŌŁĶ£Ö¹·“Ó¦”£

²½Ö趞£ŗ½«·“Ó¦ŗóµÄ»ģŗĻŅŗ¹żĀĖ£¬ĀĖŅŗÓĆÅØŃĪĖįĖį»ÆŗóÓĆĶ¼ŅŅĖłŹ¾µÄ×°ÖĆ³éĀĖµĆ“Ö²śĘ·”£
²½ÖčČż£ŗ½«“Ö²śĘ·½ųŠŠÖŲ½į¾§¼“µĆ“æĘ·±½¼×Ėį”£
¼×±½”¢±½¼×Ėį¼Ų”¢±½¼×ĖįµÄ²æ·ÖĪļĄķŠŌÖŹ¼ūĻĀ±ķ£ŗ

£Ø1£©ŅĒĘ÷AµÄĆū³ĘĪŖ___________£¬Ęä³öĖ®æŚŹĒ___________(Ģī”°a”±»ņ”°b”±)”£
£Ø2£©²½ÖčŅ»ÖŠ£¬Ó¦ŌŚČż¾±ĘæÖŠ¹Ū²ģµ½_________________________________µÄĻÖĻóŹ±²ÅĶ£Õż·“Ó¦”£
£Ø3£©·“Ó¦½įŹųŹ±£¬²āµĆČż¾±ĘæÖŠ»ģŗĻŅŗĪŖ¼īŠŌ£¬ŌņČż¾±ĘæÄŚ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_________________________________(ŌŚ±¾ŹµŃéĢõ¼žĻĀ£¬øßĆĢĖį¼ŲµÄ»¹Ō²śĪļŹĒMnO2)
£Ø4£©²½Ö趞֊³éĀĖµÄÓŵćŹĒ____________________________________________”£
£Ø5£©ČēĶ¼ŅŅĖłŹ¾³éĀĖĶź±ĻŹ±£¬Ó¦ĻȶĻæŖ______________________Ö®¼äµÄĻšĘ¤¹Ü”£
£Ø6£©²½Ö趞֊£¬Čē¹ūĀĖŅŗ³Ź×ĻÉ«£¬ŅŖĻČ¼ÓKHSO3£¬ŌŅņŹĒ______________________”£
£Ø7£©ČōĢį“æµĆµ½2.9g±½¼×Ėį£¬Ōņ¼×ĖįµÄ²śĀŹŹĒ___________%”£(±£Įōµ½Š”ŹżµćŗóŅ»Ī»)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潚ŹōīŃ¼°Ęä»ÆŗĻĪļ±»¹ć·ŗÓ¦ÓĆÓŚ·É»ś”¢»š¼ż”¢µ¼µÆ”¢ČĖŌģĪĄŠĒ”¢ÓīÖę·É“¬”¢½¢Ķ§”¢¾ü¹¤”¢Ņ½ĮĘŅŌ¼°ŹÆÓĶ»Æ¹¤µČĮģÓņ£¬ČĖĆĒ³ĘīŃĪŖ”°21ŹĄ¼Ķ½šŹō”±”£×ŌČ»½ēÖŠīѵÄŅ»ÖÖ“ęŌŚŠĪŹ½ĪŖ½šŗģŹÆ(Ö÷ŅŖ³É·ÖŹĒTiO2)”£»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)»łĢ¬īŃŌ×ӵļŪµē×ÓÅŲ¼Ź½ĪŖ__________________£¬ÓėīŃĶ¬ÖÜĘŚµÄŌŖĖŲÖŠ£¬»łĢ¬Ō×ÓµÄĪ“³É¶Ōµē×ÓŹżÓėīŃĻąĶ¬µÄŌŖĖŲ·Ö±šŹĒ_________________(ĢīŌŖĖŲ·ūŗÅ)”£
(2)īѵÄÓ²¶Č“óÓŚĀĮ£¬ĘäŌŅņŹĒ_________________________”£
(3)Ti(BH4)3ŹĒŅ»ÖÖ“¢Ēā²ÄĮĻ£¬æÉÓÉTiCl4ŗĶLiBH4·“Ó¦ÖʵƔ£
¢ŁTiCl4ČŪµćĪŖ-24”ę£¬·ŠµćĪŖ136.4”ę£¬ŹŅĪĀĻĀĪŖĪŽÉ«ŅŗĢ壬æÉČÜÓŚ¼×±½ŗĶĀČ“śĢž£¬¹ĢĢ¬TiCl4ŹōÓŚ___________¾§Ģ唣
¢ŚLiBH4ÓÉLi+ŗĶBH4-¹¹³É£¬BH4-µÄæռ乹ŠĶŹĒ______£¬BŌ×ÓµÄŌӻƹģµĄĄąŠĶŹĒ___________”£
(4)ÓĆŠæ»¹ŌTiCl4µÄŃĪĖįČÜŅŗ£¬¾ŗóŠų“¦ĄķæÉÖʵĆĀĢÉ«µÄ¾§Ģå[TiCl(H2O)5]Cl2”¤H2O”£øĆ¾§ĢåĖłŗ¬ŌŖĖŲÖŠ£¬µēøŗŠŌ×ī“óµÄŌŖĖŲŹĒ___________£¬ÓėTiŠĪ³ÉÅäĪ»¼üµÄÅäĢåŹĒ___________£¬1moløĆÅäŗĻĪļÖŠŗ¬ÓŠ¦Ņ¼üµÄŹżÄæĪŖ___________”£
(5)TiO2¾§°ūŹĒµäŠĶµÄĖÄ·½Ļµ½į¹¹£¬Ę侧°ū½į¹¹ČēĶ¼ĖłŹ¾(¾§°ūÖŠĻąĶ¬Ī»ÖƵÄŌ×ÓĻąĶ¬)£¬ĘäÖŠA”¢B”¢CµÄŌ×Ó×ų±ź·Ö±šĪŖA(0£¬0£¬0)”¢B(0.69a£¬0.69a£¬c)”¢C(a£¬a£¬c)£¬ŌņDµÄŌ×Ó×ų±źĪŖD(0.19a£¬_____£¬______)£¬īŃŃõ¼üµÄ¼ü³¤d=___________(ÓĆ“śŹżŹ½±ķŹ¾)”£

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĶ¼Ź¾Óė¶ŌÓ¦µÄŠšŹöÕżČ·µÄŹĒ(””””)
A.  ČōŅŖ³żČ„CuSO4ČÜŅŗÖŠµÄFe3+£¬ŠčŅŖµ÷½ŚČÜŅŗµÄpHŌŚ7×óÓŅ
ČōŅŖ³żČ„CuSO4ČÜŅŗÖŠµÄFe3+£¬ŠčŅŖµ÷½ŚČÜŅŗµÄpHŌŚ7×óÓŅ
B.  ±ķŹ¾·“Ó¦4CO(g)+2NO2(g)N2(g)+4CO2(g)£¬±£³ÖĘäĖūĢõ¼ž²»±ä£¬øıäCOµÄĪļÖŹµÄĮæ£¬Ę½ŗāŹ±N2µÄĢå»ż·ÖŹż±ä»ÆĒéæö”£ÓÉĶ¼æÉÖŖ£¬NO2µÄ×Ŗ»ÆĀŹ£ŗc£¾b£¾a
±ķŹ¾·“Ó¦4CO(g)+2NO2(g)N2(g)+4CO2(g)£¬±£³ÖĘäĖūĢõ¼ž²»±ä£¬øıäCOµÄĪļÖŹµÄĮæ£¬Ę½ŗāŹ±N2µÄĢå»ż·ÖŹż±ä»ÆĒéæö”£ÓÉĶ¼æÉÖŖ£¬NO2µÄ×Ŗ»ÆĀŹ£ŗc£¾b£¾a
C.  ±ķŹ¾25”ꏱ£¬·Ö±š¼ÓĖ®Ļ”ŹĶĢå»ż¾łĪŖ100 mL”¢pH£½2µÄCH3COOHČÜŅŗŗĶHXČÜŅŗ£¬Ōņ25”ꏱHXµÄµēĄėĘ½ŗā³£Źż“óÓŚCH3COOHµÄµēĄėĘ½ŗā³£Źż
±ķŹ¾25”ꏱ£¬·Ö±š¼ÓĖ®Ļ”ŹĶĢå»ż¾łĪŖ100 mL”¢pH£½2µÄCH3COOHČÜŅŗŗĶHXČÜŅŗ£¬Ōņ25”ꏱHXµÄµēĄėĘ½ŗā³£Źż“óÓŚCH3COOHµÄµēĄėĘ½ŗā³£Źż
D.  ±ķŹ¾25”ꏱ£¬Ļņ0.1 molL©1µÄNH4ClČÜŅŗÖŠµĪ¼Ó0.1 molL©1µÄŃĪĖį£¬ČÜŅŗÖŠc(H+)/c(NH4+)ĖęŃĪĖįĢå»żµÄ±ä»Æ¹ŲĻµ
±ķŹ¾25”ꏱ£¬Ļņ0.1 molL©1µÄNH4ClČÜŅŗÖŠµĪ¼Ó0.1 molL©1µÄŃĪĖį£¬ČÜŅŗÖŠc(H+)/c(NH4+)ĖęŃĪĖįĢå»żµÄ±ä»Æ¹ŲĻµ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com