
| A. | 在船舶的外壳装上铜块可防止其发生电化学腐蚀 | |
| B. | FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 | |
| C. | MnO2、FeCl3和CuSO4都可加快H2O2的分解速率 | |
| D. | 用惰性电极分别电解CuCl2溶液和MgCl2溶液分别得到单质Cu和Mg |
分析 A、两种活泼性不同的金属和合适的电解质溶液能发生电化学腐蚀;
B、含有弱根离子的盐能水解,根据酸的性质分析;
C、催化剂能加快双氧水的分解速率;
D、活泼金属采用电解熔融盐的方法制取.
解答 解:A、铜和铁的活泼性不同,铜、铁和海水能构成原电池而加快铁的电化学腐蚀,故A错误;
B、加热氯化铁溶液能加快氯化铁的水解生成氢氧化铁和盐酸,且生成的盐酸是挥发性酸,灼烧氢氧化铁,氢氧化铁分解生成氧化铁,所以如果将氯化铁溶液加热蒸干、灼烧得到Fe2O3;加热硫酸铁溶液,硫酸铁能水解生成氢氧化铁和硫酸,但硫酸不是挥发性酸,所以加热硫酸铁溶液最后得到的仍然是硫酸铁不是氧化铁,故B错误;
C、二氧化锰、氯化铁和硫酸铜可作过氧化氢分解的催化剂,都能加快双氧水的分解,故C正确;
D、金属镁是活泼金属,所以应采用电解熔融态的盐而不是电解盐溶液,故D错误.
故选C.
点评 本题考查了盐类的水解、原电池原理、金属的冶炼等知识点,易错选项是B,注意加热、灼烧硫酸铁溶液最后得到的仍是硫酸铁而不是氧化铁.


科目:高中化学 来源: 题型:解答题
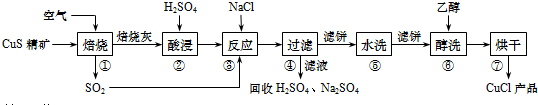
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe在少量Cl2中燃烧生成0.5 mol 产物,转移的电子数为1 NA | |
| B. | 78g Na2O2晶体中含有的阴离子数目为2NA | |
| C. | 在标准状况下,2.8g N2和2.8g CO所含电子数均为1.4NA | |
| D. | pH=13的NaOH溶液中含有的OH-的数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
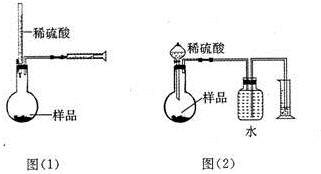 为测定NaOH、Na2C03混合物中Na2C03的质量分数,甲同学拟采用图(1)所示装置来测定.乙同学拟采用图(2)所示装置来测定.
为测定NaOH、Na2C03混合物中Na2C03的质量分数,甲同学拟采用图(1)所示装置来测定.乙同学拟采用图(2)所示装置来测定.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素A的氢化物比元素B的氢化物更稳定 | |
| B. | 元素C、D、E的最高价氧化物对应的水化物两两之间能发生反应 | |
| C. | 原子半径:C>D>B | |
| D. | 元素B的气态氢化物的沸点比元素E气态氢化物的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢与氢氧化钠反应的中和热△H=-57.3kJ/mol,则硫酸和氢氧化钡反应的△H=-2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0KJ/mol,则表示一氧化碳的燃烧热的热化学方程式为CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ/mol | |
| C. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| D. | 已知: Ⅰ:对于反应:H2(g)+Cl2(g)=2HCl(g)△H=-a kJ/mol Ⅱ:  且a、b、c均大于零,则断开1摩尔H-Cl键所需的能量为(-a-b-c) kJ/mol 且a、b、c均大于零,则断开1摩尔H-Cl键所需的能量为(-a-b-c) kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5 mol/(L•s) | B. | v(B)=0.3 mol/(L•s) | C. | v(C)=0.8 mol/(L•s) | D. | v(D)=1.0 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水得氯水,该溶液能导电,因此氯气是电解质 | |
| B. | CaCO3饱和溶液导电能力很弱,故CaCO3是弱电解质 | |
| C. | HF的水溶液中既有H+、F-,又有大量的HF分子,因此HF是弱电解质 | |
| D. | 导电能力弱的溶液肯定是弱电解质的溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com