

| 2.4mol-2.15mol |
| 2.4mol |


科目:高中化学 来源: 题型:
| A、①②③均是氧化还原反应 |
| B、氧化性强弱顺序:K2Cr2O7>Fe2(SO4)3>I2 |
| C、反应②中1mol还原剂失去电子数为6.02×1023 |
| D、反应③中氧化剂与还原剂的物质的量之比为1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某溶液+AgNO3溶液→生成白色沉淀,说明原溶液中有Cl- |
| B、某溶液+BaCl2溶液→生成白色沉淀,说明原溶液中有SO42- |
| C、某溶液+NaOH溶液→生成蓝色沉淀,说明原溶液中有Cu2+ |
| D、某溶液+稀硫酸→产生无色气体,该气体能使澄清石灰水变浑浊,则原溶液中有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
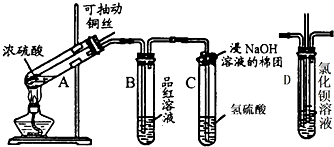
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、将水准管上提,液面高于量气管且不下降,说明装置不漏气 |
| B、若已知参加反应的Zn的质量,则该装置可用来测定气体摩尔体积 |
| C、若已知参加反应的Zn的质量,则该装置可用来测定锌的相对原子质量 |
| D、反应停止后,立即读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、W、M的某种单质可作为水处理中的消毒剂 |
| B、电解YW2的熔融物可制得Y和W的单质 |
| C、相同条件下,W的氢化物水溶液酸性比Z弱 |
| D、X、M两种元素形成的一种化合物与水反应可生成M的某种单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
2- 3 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
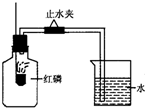 已知空气的主要成分是氮气和氧气,某课外活动小组设计测定空气中氧气含量的实验,实验装置如图所示:
已知空气的主要成分是氮气和氧气,某课外活动小组设计测定空气中氧气含量的实验,实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
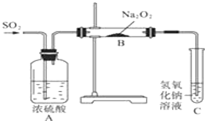 有两个实验小组探究Na2O2与SO2的反应,都用如图所示装置进行实验.
有两个实验小组探究Na2O2与SO2的反应,都用如图所示装置进行实验.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com