

| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 | Zn(OH)2 |
| 开始沉淀时的pH | 7.6 | 5.2 | 2.7 | 8.0 |
| 完全沉淀时的pH | 9.6 | 6.7 | 3.7 | 11.0 |


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
| 物 质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| 溶度积Ksp | 8.0×10-16 | 4.0×10-38 | 3×10-17 | 2.2×10-20 |

查看答案和解析>>
科目:高中化学 来源:09—10年泰州中学高二下学期期末考试化学卷 题型:填空题
(12分)通过火法冶金炼出的铜是粗铜,含杂质金、银、铁、锌,不适于电器及其他许多工业使用,必须进行电解精炼。
⑴在精炼铜时,阳极减小的质量与阴极增加的质量是否相等 ▲ (填“是”或“否”);阳极下面沉积金属的成分主要是 ▲ 。
⑵在精炼铜的过程中,Cu2+浓度逐渐下降,c(Fe2+)、c(Zn2+)会逐渐 ▲ ,所以需要定时除去其中的Fe2+、Zn2+。甲同学设计了下列除杂方案I(见下图)。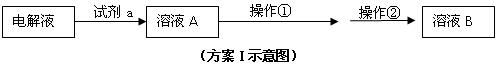
请参照下表给出的数据,回答下列问题:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 | Zn(OH)2 |
| 开始沉淀时的pH | 7.6 | 5.2 | 2.7 | 8.0 |
| 完全沉淀时的pH | 9.6 | 6.7 | 3.7 | 11.0 |
| A.NaOH | B.CuO | C.Cu(OH)2 | D.NH3·H2O E.Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源:2013届天津市高二第三次月考化学试卷(解析版) 题型:实验题
(8分)I、通过火法冶金炼出的铜是粗铜,含杂质金、银、铁、锌等金属和少量矿物杂质(与酸不反应)。制作电器及其他仪器产品时必须要求是纯铜,为此以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯。
表:几种物质形成沉淀时的pH
|
物质 |
Fe(OH)2 |
Fe(OH)3 |
Zn(OH)2 |
Cu(OH)2 |
|
开始沉淀时的pH |
7.6 |
2.7 |
5.7 |
4.7 |
|
完全沉淀时的pH |
9.7 |
3.7 |
8.5 |
7.3 |
(1)在精炼铜时,阴极电极反应方程式为 ;金、银以单质的形式沉积在电解槽 (填“阳极”或“阴极”)的槽底。
(2)在精炼铜的过程中,Cu2+浓度逐渐降低,c(Fe2+)、c(Zn2+)会逐渐增大,所以需定时除去其中的Fe2+、Zn2+。甲同学设计了如下除杂流程:

①试剂a最好选用 (填写序号),加入试剂a的目的是 。
a、氯水 b、高锰酸钾溶液 c、硝酸 d、双氧水
②操作①是 ,根据上表数据分析,除杂方案中能够除去的杂质金属阳离子是
(填化学式)。
II、重金属离子对河流海洋等会造成严重的污染。某化工厂产生的废水(pH=2.0,密度为1g·mL-1)中含有Ag+、Pb2+等重金属离子,其浓度约为0.01mol·L-1,排放前拟用沉淀法回收这两种金属,查找有关数据如下:
|
难溶电解质 |
AgI |
AgOH |
Ag2S |
PbI2 |
Pb(OH)2 |
PbS |
|
Ksp |
8.3×10-17 |
5.6×10-8 |
6.3×10-50 |
7.1×10-9 |
1.2×10-15 |
3.4×10-28 |
(1)你认为往废水中投入 (填字母序号)沉淀的效果最好
a、NaOH b、Na2S c、KI d、Ca(OH)2
(2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=
查看答案和解析>>
科目:高中化学 来源:09-10年泰州中学高二下学期期末考试化学卷 题型:填空题
(12分)通过火法冶金炼出的铜是粗铜,含杂质金、银、铁、锌,不适于电器及其他许多工业使用,必须进行电解精炼。
⑴在精炼铜时,阳极减小的质量与阴极增加的质量是否相等 ▲ (填“是”或“否”);阳极下面沉积金属的成分主要是 ▲ 。
⑵在精炼铜的过程中,Cu2+浓度逐渐下降,c(Fe2+)、c(Zn2+)会逐渐 ▲ ,所以需要定时除去其中的Fe2+、Zn2+。甲同学设计了下列除杂方案I(见下图)。
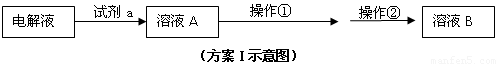
请参照下表给出的数据,回答下列问题:
|
物 质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
Zn(OH)2 |
|
开始沉淀时的pH |
7.6 |
5.2 |
2.7 |
8.0 |
|
完全沉淀时的pH |
9.6 |
6.7 |
3.7 |
11.0 |
①试剂a是 ▲ ,其目的是 ▲ 。
②操作①调节pH至b,b的取值范围是 ▲ 。
③调节溶液A的PH时可选择下列哪些试剂 ▲ 。
A.NaOH B.CuO C.Cu(OH)2 D.NH3·H2O E.Cu2(OH)2CO3
④操作②是 ▲ ,方案I中不能够除去的杂质金属阳离子是 ▲ 。
⑶乙同学在查阅课本时发现,“工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节pH至7-8,可使Fe3+生成Fe(OH)3沉淀而除去。”乙同学认为甲同学的方案I中也应该将溶液pH调至7-8。
你认为乙同学的建议是否正确? ▲ (填“是”或“否”)理由是 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com