
【题目】根据下列短周期元素性质的数据判断,下列说法正确的是
|
|
|
|
|
|
|
| |
原子半径 |
|
|
|
|
|
|
|
|
最高价或最低价 |
|
|
|
|
|
|
|
|
A. 元素![]() 形成的氢化物稳定
形成的氢化物稳定
B. 元素![]() 的非金属强,所以氢化物的沸点高
的非金属强,所以氢化物的沸点高
C. 元素![]() 形成的化合物是共价化合物
形成的化合物是共价化合物
D. 元素![]() 的最高价氧化物对应水化物的碱性最强
的最高价氧化物对应水化物的碱性最强
【答案】D
【解析】
根据表格信息,推断可知,短周期元素中,①只有最低价2,处于ⅥA族,则①为O;③⑥都最高正价+1,处于ⅠA,⑥的原子半径较大,③原子半径不是所有元素中最小,故③为Li、⑥为Na;⑤有+7、1价,则⑤为Cl;④⑦都有最高价+5、最低价3,处于ⅤA族,且④的原子半径较大,则④为P、⑦为N;②有最高价+2,处于ⅡA族,原子半径大于Li,则②为Mg;⑧有最高价+3,处于ⅢA族,原子半径大于P,则⑧为Al.
A. 元素④、⑤形成的气态氢化物分别为PH3,HCl,其中非金属性Cl>P,气态氢化物稳定性HCl>PH3,故A错误;
B. ⑦为N元素,④是P元素,气态氢化物的沸点与相对分子质量和分子间氢键有关系,NH3分子间有氢键,则NH3的沸点高于PH3,故B错误;
C. 元素①⑧形成的化合物为Al2O3,Al2O3是离子化合物,故C错误;
D. 元素⑥为Na,其最高价氧化物对应水化物是NaOH ,碱性最强,故D正确;
故选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氯气与碱溶液反应,在低温和稀碱溶液中主要产物是ClO—和Cl—,在75℃以上和浓碱溶液中主要产物是ClO3—和Cl—。研究小组用如下实验装置制取氯酸钾(KClO3),并测定其纯度。回答下列问题:
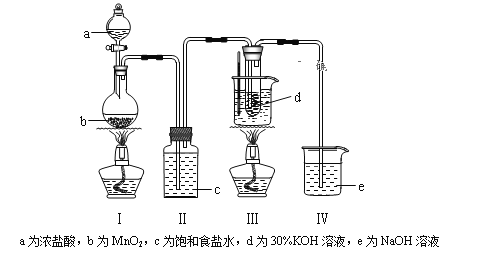
(1)检查装置气密性后,添加药品,待装置Ⅲ水温升至75℃开始反应。
①写出装置Ⅰ中反应的化学方程式为____________________________。
②若取消装置Ⅱ,对本实验的影响是____________________________。
③实验结束,拆解装置Ⅰ前为了防止大量氯气逸出,可采取的措施是_______。
(2)已知碱性条件下,ClO—有强氧化性,而ClO3—氧化性很弱。设计实验证明:碱性条件下,H2O2能被ClO—氧化,而不能被ClO3—氧化。_________________。
(3)为测定产品KClO3的纯度,进行如下实验:
步骤1:取2.45g样品溶于水配成250mL溶液。
步骤2:取25.00mL溶液于锥形瓶中,调至pH=10,滴加足量H2O2溶液充分振荡,然后煮沸溶液1~2分钟,冷却。
步骤3:加入过量KI溶液,再逐滴加入足量稀硫酸。(ClO3—+6I—+6H+=Cl—+3I2+3H2O)
步骤4:加入指示剂,用0.5000 mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。(2S2O32—+I2=S4O62—+2I—)
①步骤2的目的是________。写出煮沸时反应的化学方程式________。
②样品中KClO3的质量分数为________。(KClO3相对分子质量:122.5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.灼烧至红热的细铁丝与氯气反应生成FeCl2
B.常温常压下,22.4L SO2中含有的分子数为6.02×1023
C.纯碱溶液呈碱性,热的纯碱溶液可以去除物品表面的油污
D.Na2O2能与水或CO2反应生成O2,可用作呼吸面具中的供氧剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为________________________________________________________________________。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为________________________。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为____________________。
(4)比较Y、Z气态氢化物的稳定性________>________(用分子式表示)。
(5)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是________>________>________>________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的表示及说法正确的是
A. 已知![]()
![]() ,则氢气的燃烧热为-241.8kJ/mol
,则氢气的燃烧热为-241.8kJ/mol
B. ![]() 、101 kPa时,求算固态碳和硫的燃烧热时.其分别燃烧时生成稳定的
、101 kPa时,求算固态碳和硫的燃烧热时.其分别燃烧时生成稳定的![]() 和
和![]()
C. 含![]() 的稀溶液与稀硫酸完全中和,放出
的稀溶液与稀硫酸完全中和,放出![]() 的热量,则表示该反应的中和热的热化学方程式为:2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)
的热量,则表示该反应的中和热的热化学方程式为:2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ![]()
D. 已知![]()
![]() ,
,![]()
![]() ,则
,则![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。请针对以下三种不同情况回答:

(1)若A、B、C均为化合物且焰色反应均为黄色,水溶液均为碱性。则C物质的化学式是_____________。
(2)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素为___________。(写元素符号)
②该金属元素的单质与某红棕色粉末在高温下反应,可用于焊接铁轨,反应的化学反应方程式为__________。
若A为固态非金属单质,A与X同周期,常温常压下C为白色固体,B分子中各原子最外层均为8e-结构。C与水剧烈反应,生成两种常见酸,反应的化学方程式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com