
运用相关化学知识进行判断,下列结论错误的是
A.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中
C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底
D.需要加热的反应不一定是吸热反应
科目:高中化学 来源:2015届广东省深圳市高三上学期第一次五校联考理综化学试卷(解析版) 题型:填空题
(16分)醋酸是一种常见的弱酸。
(1)假如某醋酸溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为
mol/L;计算此时醋酸的电离平衡常数,写出计算过程。[注: c平衡(CH3COOH)≈0.10mol/L,水的电离可忽略不计]
(2)为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,准备了以下化学用品:0.20 mol·L-1与0.40 mol·L-1的HCl溶液、0.20 mol·L-1与0.40 mol·L-1的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298 K和308 K。
①酸液都取足量、相同体积,请你帮助完成以下实验设计表:
实验 编号 | 温度 (K) | 盐酸浓度 (mol·L-1) | 醋酸浓度 (mol·L-1) | 实验目的 |
a | 298 | 0.20 |
| I.实验a和b是探究 对镁与盐酸反应速率的影响; II.实验a和c是探究 对镁与盐酸反应速率的影响; III.实验a和d是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别 |
b | 308 | 0.20 |
| |
c | 298 | 0.40 |
| |
d |
|
|
|
②若①中实验a镁条消失的时间是20 s,则镁条剩余质量与时间关系图如下图。假设:该反应温度每升高10 ℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在此图中大致画出“实验b”、“实验d”的镁条剩余质量与时间关系曲线,请注意必要的标注。

(3)镁及其化合物在生产和生活中有着广泛的应用,依据镁的性质、用途等回答下列问题:
已知:①Mg(s)+2H2O(g)===Mg(OH)2(s)+H2(g) ΔH1=-441 kJ·mol-1
②H2O(g)===H2(g)+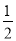 O2(g) ΔH2=+242 kJ·mol-1
O2(g) ΔH2=+242 kJ·mol-1
③Mg(s)+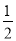 O2(g)===MgO(s) ΔH3=-602 kJ·mol-1。
O2(g)===MgO(s) ΔH3=-602 kJ·mol-1。
则氢氧化镁分解的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第一次调研考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列叙述正确的是
A.1mol?L-1 NaHCO3溶液中的Na+数为NA
B.常温时,2.24LCO2所含的氧原子数为0.2NA
C.5.6g Fe与足量稀盐酸反应,转移电子数为0.2NA
D.标准状况下,2.24L CCl4所含分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三上学期第一次质量检测化学试卷(解析版) 题型:填空题
(16分)水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g)  CO (g) +H2 (g) △H= +131.3 kJ?mol-1
CO (g) +H2 (g) △H= +131.3 kJ?mol-1
(1)该反应的平衡常数K随温度的升高而___________(增大 / 减小 / 不变)。
(2)上述反应达到平衡后,将体系中的C (s)全部移走,平衡_______________(向左移 / 向右移 / 不移动)。
(3)下列事实能说明该反应在一定条件下已达到平衡状态的有_______(填序号)。
A.单位体积内每消耗1 mol CO的同时生成1molH2
B.混合气体总物质的量保持不变
C.生成H2O(g)的速率与消耗CO的速率相等
D.H2O(g)、CO、H2的浓度相等
(4)上述反应在t0时刻达到平衡(如下图),若在t1时刻改变某一条件,请在右图中继续画出t1时刻之后c(CO)随时间的变化。

① 缩小容器体积(用实线表示)。
② 降低温度(用虚线表示)。
(5)某温度下,将6.0 mol H2O(g)和足量的炭充入2 L的密闭容器中,发生如下反应,
C (s) + H2O(g)  CO (g) +H2 (g),达到平衡时测得lgK= -1.0,求此温度下H2O(g)的
CO (g) +H2 (g),达到平衡时测得lgK= -1.0,求此温度下H2O(g)的
转化率(计算结果保留3位有效数字,要求写出计算过程)。
(6)己知:① C (s) + H2O(l)  CO (g) +H2 (g) △H1
CO (g) +H2 (g) △H1
② 2CO(g) + O2(g) = 2CO2 (g) △H 2
③ H2O (l)= H2 (g) +1/2 O2 (g) △H 3
则2C (s) + O2 (g) = 2CO2 (g)的△H = _________ ____。
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市海珠区高三8月摸底考试理综化学试卷(解析版) 题型:填空题
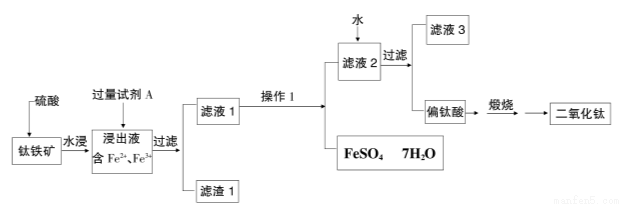
(16分)二氧化钛(TiO2)又称钛白,工业上利用钛铁矿(主要成分FeTiO3,其中铁为正二价)为原料,采用硫酸法制得,其工艺流程如下图所示
请回答:
(1)铁矿加入硫酸反应可制得硫酸氧钛,其反应的化学方程式为:
FeTiO3+ 2H2SO4=( )TiOSO4+( )+( );
(2)为了提高二氧化钛的纯度,需要除去浸出液中的Fe3+,则加入的试剂A为 ,需过量的原因是 。
(3)操作1是 。
(4)进行操作1时需将滤液1在70-75℃,压力8000Pa的条件下真空蒸发器中进行,其原因是为了防止 ,滤液2加水稀释使硫酸氧钛(TiOSO4)水解生成偏钛酸(TiO2·nH2O),请写出该水解反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市海珠区高三8月摸底考试理综化学试卷(解析版) 题型:选择题
水溶液中能大量共存的一组离子是
A.K+、Ca2+、Cl-、SO42- B.Fe2+、H+、CO32-、ClO-
C.Mg2+、NH4+、Cl-、SO42- D.H+、Fe3+、NO3-、SCN-
查看答案和解析>>
科目:高中化学 来源:2015届安徽省高三九月份化学月考试卷(解析版) 题型:选择题
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变。
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+。
C.硫酸铜水溶液里加入氨水生成的沉淀是氢氧化铜,继续加氨水沉淀又溶解,说明氢氧化铜是两性氢氧化物。
D.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道。
查看答案和解析>>
科目:高中化学 来源:2015届安徽省六校教育研究会高三第一次联考化学试卷(解析版) 题型:选择题
在恒温恒压下,向密闭容器中充入4molSO2和2molO2,发生如下反应:
2SO2(g)+O2(g) 2SO3(g) △H<0 。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ,则下列分析正确的是
2SO3(g) △H<0 。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ,则下列分析正确的是
A.在该条件下,反应前后的压强之比为6 :5.3
B.若反应开始时容器体积为2L,则v(SO3)=0.35mol/(L·min)
C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3) < 1.4mol
D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com