
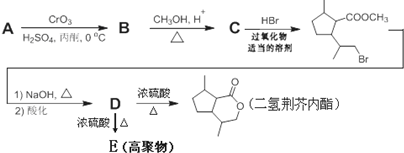
 ,B含有的非氧官能团的名称碳碳双键.C与HBr发生的反应类型是加成反应.
,B含有的非氧官能团的名称碳碳双键.C与HBr发生的反应类型是加成反应.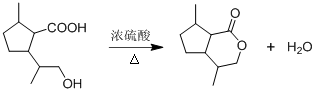 .
. .
. ,其分子中最多有8个碳原子在同一平面上.
,其分子中最多有8个碳原子在同一平面上.
分析 A的分子式为C10H16O,不饱和度为$\frac{2×10+2-16}{2}$=3,A的结构中有一个五元环,结合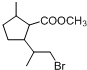 的结构可知A为
的结构可知A为 ,A发生氧化反应得到B为
,A发生氧化反应得到B为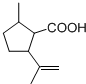 ,B与甲醇发生转化反应得到C为
,B与甲醇发生转化反应得到C为 ,C再与HBr反应加成反应得到
,C再与HBr反应加成反应得到 ,在碱性条件下发生水解反应、酸化得到D为
,在碱性条件下发生水解反应、酸化得到D为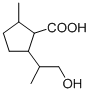 ,D发生酯化反应得到二氢荆芥内酯,D发生缩聚反应得到高聚物E为
,D发生酯化反应得到二氢荆芥内酯,D发生缩聚反应得到高聚物E为 .
.
解答 解:A的分子式为C10H16O,不饱和度为$\frac{2×10+2-16}{2}$=3,A的结构中有一个五元环,结合 的结构可知A为
的结构可知A为 ,A发生氧化反应得到B为
,A发生氧化反应得到B为 ,B与甲醇发生转化反应得到C为
,B与甲醇发生转化反应得到C为 ,C再与HBr反应加成反应得到
,C再与HBr反应加成反应得到 ,在碱性条件下发生水解反应、酸化得到D为
,在碱性条件下发生水解反应、酸化得到D为 ,D发生酯化反应得到二氢荆芥内酯,D发生缩聚反应得到高聚物E为
,D发生酯化反应得到二氢荆芥内酯,D发生缩聚反应得到高聚物E为 .
.
(1)A的结构简式为 ,B为
,B为 ,含有的非氧官能团为碳碳双键,C与HBr发生的反应类型是加成反应,
,含有的非氧官能团为碳碳双键,C与HBr发生的反应类型是加成反应,
故答案为: ;碳碳双键;加成反应;
;碳碳双键;加成反应;
(2)由D生成二氢荆芥内酯的化学方程式为: ,
,
故答案为: ;
;
(3)D为 ,含有羧基、羟基,在某催化剂作用下可发生羧基反应,生成一种高聚物的结构简式为
,含有羧基、羟基,在某催化剂作用下可发生羧基反应,生成一种高聚物的结构简式为 ,
,
故答案为: ;
;
(4)符合以下条件的二氢荆芥内酯的同分异构体:①结构中含有苯环,则侧链没有不饱和键; ②只有一个侧链,③能发生酯化反应,含有羟基,④不能发生消去反应,该同分异构体结构简式为: ,苯环为平面结构,旋转碳碳单键可以使亚甲基或甲基中碳原子处于苯的平面结构内,最多有8个碳原子处于同一平面内,
,苯环为平面结构,旋转碳碳单键可以使亚甲基或甲基中碳原子处于苯的平面结构内,最多有8个碳原子处于同一平面内,
故答案为: ;8.
;8.
(5)已知:同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮.完成下列合成内酯路线: ,补全合成路线流程图为:
,补全合成路线流程图为: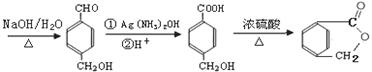 ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,充分利用合成路线中物质的结构简式、反应条件进行推断,需要学生熟练掌握官能团的性质与转化,较好的考查学生分析推理能力、知识迁移运用能力,难度中等.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH3 | B. | CH2=CH-CH3 | C. | CH2=CH-CH2-CH3 | D. | CH2=C(CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 4种 | C. | 9种 | D. | 13种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,写出CO2的电子式
,写出CO2的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 工业合成气(CO2、CO、H2)在催化剂作用下,于密闭容器中同时存在如下三个反应:
工业合成气(CO2、CO、H2)在催化剂作用下,于密闭容器中同时存在如下三个反应:| A. | 由图可知:Pl<P2 | |
| B. | 升高温度反应Ⅱ的平衡常数减小 | |
| C. | 恒压绝热下向反应器中加Ar(g).反应Ⅲ一定不移动 | |
| D. | 其它条件不变,起始时改变CO和CO2比例,平衡时CO转化率不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com