
金属汞在加热条件下可以与氧气化合生成氧化汞,反应如下:2Hg+O2=2HgO,下列哪个选项可以说明0.3mol Hg 与0.1mol O2 充分反应后物质的种类及其量的情况?( )
|
| A. | 0.2molHgO+0.1molHg | B. | 0.2molHgO |
|
| C. | 0.2molHgO+0.1molO2 | D. | 0.1molHgO+0.1molHg |
科目:高中化学 来源: 题型:
(1)已知下列反应在一定条件下可以发生:
H 2 O 2 +2Fe 2+ +2H + ====2Fe 3+ +2H 2 O
H 2 O 2 +2Fe 3+ ====2Fe 2+ +O 2 ↑+2H +
(1)在以上反应中Fe 2+ 实际上起着_________作用,总反应式为____________________。
(2)I 2 也与Fe 2+ 一样发生上述类似反应,类比(1)在下面填入配平的合适的化学反应方程式:H 2 O 2 +I 2 ====2HIO
__________________________________。
总反应式为__________________________________。
(3)在H 2 SO 4 和KI的混合溶液中加入足量的H 2 O 2 ,放出大量的无色气体,溶液呈棕色,并可以使淀粉变蓝。有学生认为该反应的离子方程式为:H 2 O 2 +2I - ====I 2 +O 2 ↑+2H + ,这个方程式正确吗?__________________________________。
若正确,理由是(若认为不正确,该步不必作答)__________________。
若不正确,原因是(若认为正确,该步不必作答)__________________,并写出正确的化学反应方程式为(若是离子反应,写出离子反应式,没有离子反应的,写出化学反应方程式):_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求完成以下化学方程式:
(1)铁在氯气中燃烧 ;
(2)氯气与氢氧化钠溶液反应: ;
(3)浅黄色的过氧化钠固体和水反应: ;
(4)钠与硫酸铜溶液反应 .
查看答案和解析>>
科目:高中化学 来源: 题型:
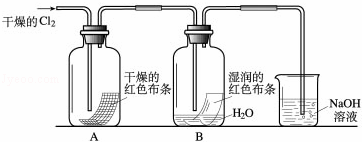
为了探究HClO的漂白性,某同学设计了如下的实验.
(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是 ;从集气瓶B中湿润的红色布条的现象可得出的结论是 .
(2)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是 .
(3)烧杯中溶液所起的作是 .
(4)为保证实验安全,当氯气以每分钟1.12L(标准状况)的流速匀速通入时,若实验需耗时4分钟,小烧杯中盛2mol•L﹣1的NaOH溶液的体积至少应为多少?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
①久置于空气中的氢氧化钠溶液,加盐酸时有气体产生
②浓硫酸可用于干燥氨气、二氧化氮气体
③SiO2和CO2都是酸性氧化物,都能与强碱溶液反应,但不能与任何酸反应
④玻璃、水泥、水晶项链都是硅酸盐制品
⑤蔗糖炭化的演示实验中,浓硫酸既体现了其强氧化性又体现了其脱水性.
|
| A. | ①④⑤ | B. | ①⑤ | C. | ②③④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
若原子核外电子的排布的基本规律为最外层电子数不超过5个,次外层电子数不超过10个,倒数第三层电子数不超过15个,而各电子层电子的最大容量仍为2n2,则元素周期表中第三、第四、第五周期含有的元素分别有( )
A. 5种、10种、15种 B. 8种、18种、18种
C. 8种、10种、15种 D. 9种、10种、15种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com