
| A.加入KSCN溶液一定不变红色 | B.溶液中一定含Cu2+ |
| C.溶液中一定含Fe2+ | D.剩余固体中一定含铜 |


科目:高中化学 来源:不详 题型:问答题

| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 2.01 | 7.11 |
| 万全沉淀的pH | 4.77 | 3.68 | 9.61 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
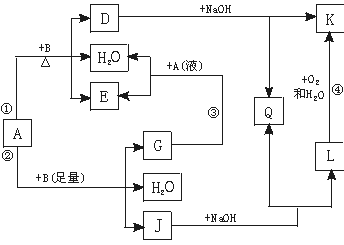
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若无固体剩余,则溶液中一定有Fe3+ |
| B.若有固体存在,则溶液中一定有Fe2+ |
| C.若溶液中有Cu2+,则一定没有固体析出 |
| D.若溶液中有Fe2+,则一定有Cu析出 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

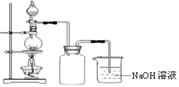
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.45mL | B.50mL | C.40mL | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
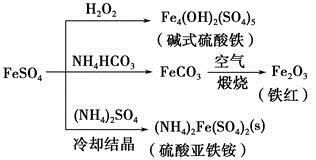
| A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用做净水剂 |
| B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 |
| C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 |
| D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com