


科目:高中化学 来源: 题型:
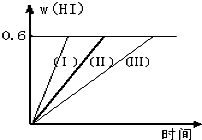 将1mol I2(g) 和2mol H2置于2L密闭容器中,在一定温度下发生反应:
将1mol I2(g) 和2mol H2置于2L密闭容器中,在一定温度下发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:
A、ρ=
| ||
B、W=
| ||
C、W=
| ||
D、C=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制的氯水可使蓝色的石蕊试纸先变红后褪色 |
| B、电解饱和食盐水阴极产生氯气 |
| C、漂白粉是混合物,有效成分是氯化钙 |
| D、漂白粉性质稳定,可以敞放在空气中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为酸性 | ||
| B、水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在 | ||
C、往0.1mol/LCH3COOH溶液中通人少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中
| ||
| D、等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3⑤NH4HCO3中c(CO32-)的大小关系为:②>④>③>⑤>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol12C18O2中,所含的中子数为22NA |
| B、常温下,1Llmol?L-1Na2CO3溶液中所含的CO32-为NA |
| C、58g乙烯和乙烷的混合气体中碳原子数目一定为4NA |
| D、常温常压下,足量的Fe在lmolCl2中充分燃烧,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H<0,△S>0 |
| B、△H>0,△S>0 |
| C、△H>0,△<0 |
| D、△H<0,△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
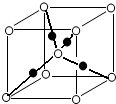 下表为长式周期表的一部分,其中的序号代表对应的元素.
下表为长式周期表的一部分,其中的序号代表对应的元素.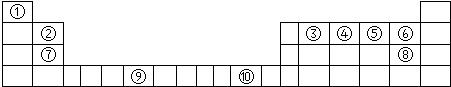
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com