
【题目】已知X和Y能发生如下反应:X+Y=H2O+盐,下列有关物质X和Y所属种类的判断中一定不正确的是( )
A. X为酸、Y为碱 B. X为碱性氧化物、Y为酸
C. X为盐、Y为碱 D. X为碱性氧化物、Y为酸性氧化物
科目:高中化学 来源: 题型:
【题目】向20mL0.5mol L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法中错误的是

A. 由水电离出的c(H+):C点>B点
B. 醋酸的电离平衡常数:B点> A点
C. 从A点到B点,混合溶液中可能存在:c( CH3COO-) = c(Na+)
D. C 点混合溶液中一定存在:c(Na+) =2c(CH3COO-) +2c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中抗氧化剂的残留量是以游离SO2的含量计算,我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。某兴趣小组设计实验方案对葡萄酒中SO2进行测定。
Ⅰ.定性实验方案如下:
(1)将SO2通入水中形成SO2 ─饱和H2SO3溶液体系,此体系中存在多个含硫元素的平衡,分别用平衡方程式表示为_______________。
(2)利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如下实验:

实验结论:干白葡萄酒不能使品红溶液褪色,原因为:_________________________。
Ⅱ.定量实验方案如下(部分装置和操作略):
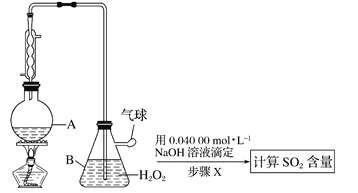
(3)仪器A的名称是________________。
(4)A中加入100.0mL葡萄酒和适量盐酸,加热使SO2全部逸出并与B中H2O2完全反应,其化学方程式为______________。
(5)除去B中过量的H2O2,然后再用NaOH标准溶液进行滴定, 除去H2O2的方法是__________。
(6)步骤X滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2的含量为__________g/L。该测定结果比实际值偏高,分析原因________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用I2O5消除CO污染的反应为5CO(g) +I2O5(s) ![]() 5CO2(g) +I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2的体积分数随时间t变化曲线如图。下列说法正确的是
5CO2(g) +I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2的体积分数随时间t变化曲线如图。下列说法正确的是

A. 该反应的△H>0
B. T1时CO的平衡转化率为80%
C. 反应处于c点时,一定有v正= v逆
D. d点时,向恒容容器中充入2mol CO,再次平衡后,CO2的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加徳罗常数的值,下列说法中正确的是
A. 8.0g Cu2S和CuO的混合物中含有铜原子数为0.1 NA
B. 常温常压下,36g 18O2中所含的中子数为16 NA
C. 电解饱和食盐水时,阳极上生成22.4L气体时转移的电子数为2 NA
D. 标准状况下,11.2LH2O中含有H—O键的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是( )
A.碳酸氢钠能与碱反应,可用作食品膨松剂
B.MgO的熔点很高,可用于制作耐高温材料
C.二氧化硫具有漂白性,可用其水溶液吸收溴蒸气
D.氯化铁溶液呈酸性,可用于蚀刻铜电路板
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com