
| A. | 按系统命名法,化合物(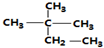 )的名称为2-甲基-2-乙基丙烷 )的名称为2-甲基-2-乙基丙烷 | |
| B. | 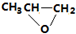 和CO2转化为 和CO2转化为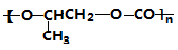 的反应符合绿色化学的原则 的反应符合绿色化学的原则 | |
| C. | 用新制氢氧化铜悬浊液无法检验失去标签的乙醇、乙醛、乙酸三瓶无色溶液 | |
| D. | 乙醇和乙醚互为同分异构体,沸点乙醇比乙醚高 |
分析 A、烷烃命名中2号碳出现乙基,说明选取的不是最长碳链;
B、绿色化学是指化学反应过程中以“原子经济性”为基本原则,即在获取新物质的化学反应中充分利用参与反应的每个原料原子,实现“零排放”,不仅充分利用资源,而且不产生污染,据此进行判断;
C、乙醇、乙醛、乙酸分别与氢氧化铜悬浊液混合的现象为:无现象、砖红色沉淀、蓝色溶液;
D、乙醇和乙醚的分子式不同.
解答 解:A、烷烃命名中2号碳出现乙基,说明选取的不是最长碳链,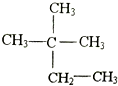 最长碳链为4,正确命名应为2,2-二甲基丁烷,故A错误;
最长碳链为4,正确命名应为2,2-二甲基丁烷,故A错误;
B、该反应中,反应物原子完全转化成目标产物,实现了0排放,且不产生污染物,符合绿色化学的原则,故B正确;
C、乙醇、乙醛、乙酸分别与氢氧化铜悬浊液混合的现象为:无现象、砖红色沉淀、蓝色溶液,现象不同,可鉴别,但是乙醇乙酸均有气味,故C错误;
D、乙醇和乙醚的分子式不同,不是同分异构体,故D错误;故选B.
点评 本题主要考查的是同系物的概念、蛋白质的性质、绿色化学的概念等,综合性较强,但是难度不大.


科目:高中化学 来源: 题型:选择题
| A. | SO2气体通入NaOH溶液中,产生倒吸现象,说明SO2极易溶于水 | |
| B. | SO2气体通入溴水中,溴水的颜色褪去,说明SO2具有漂白性 | |
| C. | SO2气体通入酸性KMnO4溶液中,溶液的颜色变浅,说明SO2具有还原性 | |
| D. | SO2气体通入Ba(NO3)2溶液中,溶液出现浑浊现象,说明有BaSO3沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D元素处于元素周期表中第3周期第Ⅳ族 | |
| B. | 四种元素的原子半径:r(A)<r(B)<r(C)<r(D) | |
| C. | B、D的最高价氧化物中,B、D与氧原子均为双键 | |
| D. | 一定条件下,B单质能转换出D单质,C产单质能置换出A单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应属加成反应 | B. | 乙烯可以通过石油裂解获得 | ||
| C. | 乙醇官能团为羟基 | D. | 乙醇、乙醛和乙酸互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
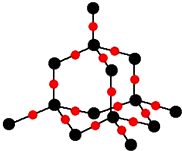 现代世界产量最高的金属是Fe、Al、Cu.
现代世界产量最高的金属是Fe、Al、Cu. )分子中碳原子杂化类型为SP2,分子中σ键比π键多5个.
)分子中碳原子杂化类型为SP2,分子中σ键比π键多5个.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
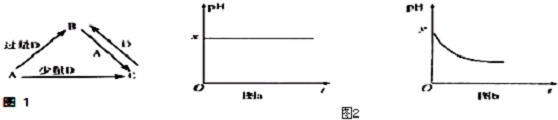
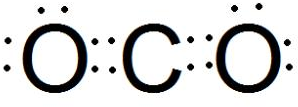 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
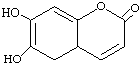
| A. | M的相对分子质量是178 | |
| B. | M有机物中含有2种官能团 | |
| C. | M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H9O5Na | |
| D. | 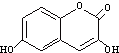 与M互为同分异构体 与M互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n( N2) | 0 | 0.20 | 0.35 | 0.40 | 0.40 |
| T2 | n( N2) | 0 | 0.25 | … | 0.30 | 0.30 |
| A. | 10min内,T1时的v(N2)比T2时的小 | |
| B. | T1<T2 | |
| C. | a<0 | |
| D. | T2时,若向平衡后的容器中再充入1.2molCH4,重新达到平衡时n(N2)=0.40mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2 | B. | 4:l3 | C. | 3:4 | D. | 3:5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com