
| X | ||
| Y | Z | W |
| T |
| A. | X、W、Z 元素的气态氢化物的热稳定性均依次递减 | |
| B. | Y、Z、W 元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增 | |
| C. | 液态WX3 气化均需克服分子间作用力 | |
| D. | 根据元素周期律,可以推测T 元素的单质具有半导体的特性 |
分析 X、Y、Z、W为短周期元素,由元素周期表可知:X应位于第二周期,且应处于周期表中右半部分,W与X处于同一主族,且W元素原子的核电荷数为X元素的2倍,那么X为O,W为S,据此结合选项判断即可.
解答 解:X、Y、Z、W为短周期元素,由元素周期表可知:X应位于第二周期,且应处于周期表中右半部分,W与X处于同一主族,且W元素原子的核电荷数为X元素的2倍,那么X为O,W为S,那么Z为P,T为As,Y为Si,
A、元素的非金属性越强,其气态氢化物越稳定,由于非金属性O>S>P,故H2O>H2S>H3P,故A正确;
B、S元素在自然界中存在游离态单质,常在火山口附近,故B错误;
C、WX3 为SO3,属于分子晶体,气化均需克服分子间作用力,故C正确;
D、As处于元素周期表的金属与非金属分界线上,具有半导体的性能,故D正确,
故选B.
点评 本题考查元素的位置与性质、结构的关系,难度不大,解题是时注意元素的性质的递变规律及其应用.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| B. | 血液透析是利用了胶体的性质 | |
| C. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| D. | 点燃爆竹后,硫燃烧生成SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在KHC2O4溶液中,c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-) | |
| B. | 在KHC2O4溶液中,c(HC2O4-)+c(C2O42-)=c(K+) | |
| C. | 草酸与酸性高锰酸钾溶液反应的速率先增大后减小 | |
| D. | 草酸分子中碳元素为+3价,易发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
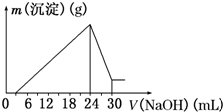 铝是现今人类生产生活中使用广泛性仅次于铁的重要金属.工业上常以“钒土矿”为原料来冶炼金属铝.已知:钒土的主要成分是Al2O3(其中含有Fe2O3、SiO2等杂质).为了检测某“钒土矿”样中Al2O3的含量,进行了如下实验过程:
铝是现今人类生产生活中使用广泛性仅次于铁的重要金属.工业上常以“钒土矿”为原料来冶炼金属铝.已知:钒土的主要成分是Al2O3(其中含有Fe2O3、SiO2等杂质).为了检测某“钒土矿”样中Al2O3的含量,进行了如下实验过程:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
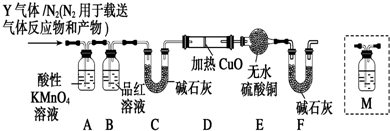
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com