
分析 根据钠与水反应生成了氢氧化钠及铝与氢氧化钠反应生成了偏铝酸钠和氢气,据此写出反应的离子方程式;根据反应计算出生成的氢气、偏铝酸钠的物质的量及质量,再根据溶质质量分数的公式求出溶液的溶质质量分数.
解答 解:钠和水反应生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑;
铝与碱反应生成偏铝酸钠和氢气,所以化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,则离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
由反应离子方程式可知,钠和铝反应的物质的量之比为1:1,所以将amol钠和amol铝一同投入mg足量水中,钠、铝能恰好反应最终得到amolNaAlO2,
根据方程式知反应过程中共得到H2的物质的量为:$\frac{1}{2}$a+$\frac{3}{2}$a=2amol,生成NaAlO2的物质的量为amol,
则所得溶液中溶质的质量为:amol×82g/mol=82ag,溶液的质量为:23ag+27ag+mg-4ag=(46a+m)g,
故所得溶液的溶质质量分数为:ω(NaAlO2)=$\frac{82ag}{(46a+m)g}$×100%=$\frac{8200a}{46a+m}$%,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;2Al+2OH-+2H2O=2AlO2-+3H2↑;$\frac{8200a}{46a+m}$%.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,要求学生能够正确书写常见反应的离子方程式,试题侧重考查学生的分析能力、理解能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
| X | Y | Z | |
| W |
 (1)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为
(1)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| B. | 氮的固定只有在高温、高压、催化剂的条件下才能实现 | |
| C. | 服用铬含量超标的药用胶囊会对人体健康不会造成危害 | |
| D. | 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
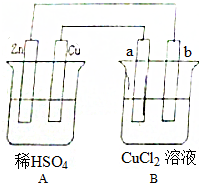
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
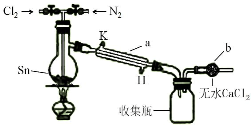 四氯化锡(SnCl4)在电子、化工等领域有重要用途.某兴趣小组拟用Sn和Cl2反应制备SnCl4.
四氯化锡(SnCl4)在电子、化工等领域有重要用途.某兴趣小组拟用Sn和Cl2反应制备SnCl4.| 实验内容 | 实验现象 | 结论 |
| 实验1:滴入KI溶液,再加淀粉溶液 | 溶液最终变为蓝色 | 产品中含有Cl2 |
| 实验2:① | ② | |
| 实验3:③ | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
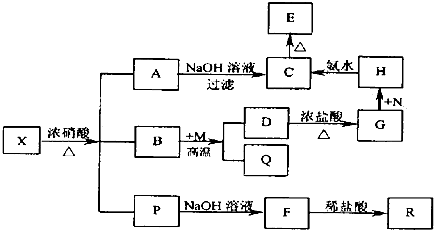
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
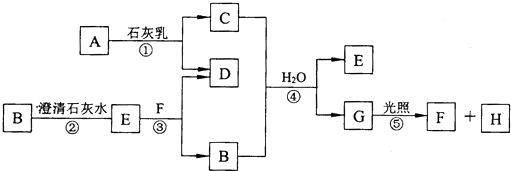
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
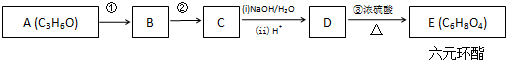
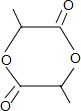 +2H2O.
+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com