到2013午云南已连续4年干旱,专家认为云南和其他城市一样受到全球变暖的气候变化影响.CO
2等温室气体是导致全球变暖的主要原因,控制和治理CO
2是解决温室效应的有效途径.
(1)将CO
2转化成有机物实现碳循环是目前最有效的降低大气中CO
2的含量的办法.如:
2CO
2(g)+2H
2O(l)═C
2H
4(g)+3O
2(g)△H=+1411.0kJ?mol
-12CO
2(g)+2H
2O(l)═C
2H
5OH(l)+3O
2(g)△H=+1366.80kJ?mol
-1则由C
2H
5OH(1)转化为C
2H
4(g)和H
2O(l)的热化学方程式为
.
(2)二氧化碳合成甲醇是碳减排的新方向,将CO
2转化为甲醇的化学方程式为:
CO
2(g)+3H
2(g)?CH
30H(g)+H
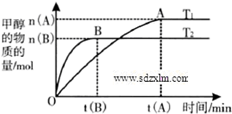
2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如图:
①该正反应的△H
0(填“>”“<”或“=”);
②其它条件不变,下列措施中,既可提高反应速率,又可提高CO
2的转化率的是
.
A.降低温度
B.CO
2的起始量不变,提高氢碳比[
]
C.加压
D.将CH
3OH或水蒸气及时吸收以降低产物浓度
③温度为573K.密闭容器的容积恒定为VL,CO
2的起始投料为a mol且起始时n(
)=1.6,若CO
2的平衡转化率为20%,计算573K时该反应的平衡常数K=
;
④取五份等量的混合气体(CO
2和H
2的物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,作出甲醇的体积分数[φ(CH
3OH)]随反应温度(T)变化的关系图.下列示意图中,可能与实验结果相符的是
(填字母编号).

(3)0.2mol CO
2被200mL l.5mol?L
-1 NaOH溶液完全吸收后所得溶液中各离子浓度大小的顺序为
.
(4)CO
2可以用Ca(OH)
2吸收得到CaCO
3,CaCO
3是一种难溶物质,其K
SP=2.8×l0
-9(25℃).25℃时将体积比为1:1的CaCl
2溶液与Na
2CO
3溶液混合,若混合前Na
2CO
3溶液的浓度为2×10
-4mol?L
-1,则生成沉淀所需原CaCl
2溶液的最小浓度为
.

 到2013午云南已连续4年干旱,专家认为云南和其他城市一样受到全球变暖的气候变化影响.CO2等温室气体是导致全球变暖的主要原因,控制和治理CO2是解决温室效应的有效途径.
到2013午云南已连续4年干旱,专家认为云南和其他城市一样受到全球变暖的气候变化影响.CO2等温室气体是导致全球变暖的主要原因,控制和治理CO2是解决温室效应的有效途径.


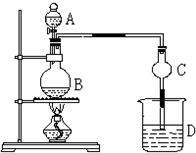 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸,D中放有饱和碳酸钠溶液.(已知:无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH)请回答下列问题:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸,D中放有饱和碳酸钠溶液.(已知:无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH)请回答下列问题: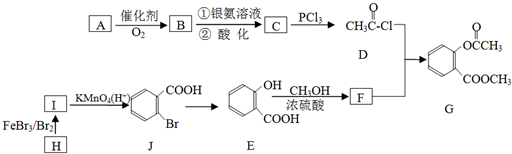
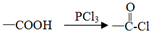
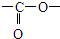 结构
结构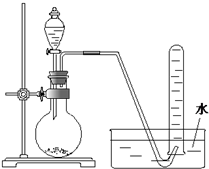
 X元素在第3周期中电负性最大,Y、Z元素同主族且位置相邻,Y原子的最外层电子排布为nsnnpn+2.请填写下列空白.
X元素在第3周期中电负性最大,Y、Z元素同主族且位置相邻,Y原子的最外层电子排布为nsnnpn+2.请填写下列空白.