
��15�֣�����������ʵ�����ɳ�����չ����Ҫ����ͼ���Ժ�H2S���ʵ���Ȼ��Ϊԭ����ȡ����������ͼ��

�ش��������⣺
��1����Ӧ�ڵĻ�ѧ����ʽΪ ��
��2����Ӧ�ܵ����ӷ���ʽΪ ��
��3�����������������ԭ�����£�
��CH4(g)��H2O(g) CO(g)��3H2(g) ��H����206.4 kJ��mol��1
CO(g)��3H2(g) ��H����206.4 kJ��mol��1
��CO(g)��H2O(g)  CO2(g)��H2(g) ��H����41.2 kJ��mol��1
CO2(g)��H2(g) ��H����41.2 kJ��mol��1
�ٶ��ڷ�Ӧ��һ���������ƽ����ϵ��H2�İٷֺ��������ܼӿ췴Ӧ���ʵĴ�ʩ�� ������ĸ���ţ���
a�������¶� b������ˮ����Ũ�� c��������� d������ѹǿ
�����÷�Ӧ��CO��һ��ת���������H2�IJ�������1.00 mol CO��H2�Ļ�����壨CO���������Ϊ20%����H2O��Ӧ���õ�1.18 mol CO��CO2��H2�Ļ�����壬��CO��ת����Ϊ ��
��������Ȼ����������������Ϊ5%���Ҽ�����ˮ������Ӧת���ɶ�����̼����������ת����Ϊ80%����ͨ����������1.00 m3 ��Ȼ�������Ͽ��Ƶ����� m3��ͬ��ͬѹ�����£���
��4��һ�������£���ͼ��ʾװ�ÿ�ʵ���л���ĵ绯ѧ���⣨���ɵ��л���Ϊ���壬���������л����
������Ŀ�����ĵ缫��ӦʽΪ ��
�ڸô���װ�õĵ���Ч��Ϊ�ǣ� �����ǣ�  ��100%������������С�����1λ��
��100%������������С�����1λ��

��1��2NH4HS��O2��2NH3��H2O��2S�� ��2�֣���2��SO2��I2��2H2O��4H+��SO42����2I�� ��2�֣�
��3���� a ��2�֣� �� 90% ��2�֣� �� 3.09 ��2�֣�
��4���� C6H6��6H����6e����C6H12 ���л����д�ṹ��ʽ����2�֣� �� 51.7% ��3�֣�
��������
�����������1���������������ԣ����������������ɵ���S�����������ͼ��֪��Ӧ�ڵĻ�ѧ����ʽΪ2NH4HS��O2��2NH3��H2O��2S����
��2����ˮ���������ԣ�������SO2�������ᣬ��Ӧ�ܵ����ӷ���ʽΪSO2��I2��2H2O��4H+��SO42����2I����
��3��������Ӧ�������������ȷ�Ӧ����a�������¶ȷ�Ӧ��������ƽ��������Ӧ������У�������������������ȷ��b������ˮ����Ũ�ȣ���Ӧ��������ƽ��������Ӧ�����ƶ���������������һ��������c����������ӿ췴Ӧ���ʵ�ƽ�ⲻ�ƶ��������������䣬����d������ѹǿ����Ӧ���ʽ��ͣ�����ѡa��
��1.00 mol CO��H2�Ļ�����壨CO���������Ϊ20%����CO�����������ʵ����ֱ���0.2mol��0.8mol������H2O��Ӧʱ����CO�����ʵ�����xmol������ݷ���ʽ��֪����CO2�����������ʵ����ֱ��Ƕ���xmol�����ں�õ�1.18 mol CO��CO2��H2�Ļ�����壬��0.2��x��x��0.8��x��1.18�����x��0.18������CO��ת����Ϊ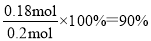 ��
��
��������Ȼ����������������Ϊ5%���Ҽ�����ˮ������Ӧת���ɶ�����̼����������ת����Ϊ80%����H2S�������0.05m3��������0.95m3��0.05m3H2S���տ��Եõ�����0.05m3�����ݷ�ӦI��֪���������������0.95m3��80%��3��2.28m3��CO�������0.95m3��80%��0.76m3����ͨ����Ӧ������������0.76m3������ͨ����������1.00 m3 ��Ȼ�������Ͽ��Ƶ�����0.05m3��2.28m3��0.76m3��3.09m3��
��4���ٸ��������֪��ʵ���Ŀ���ǵ绯ѧ���⣬���������Ϸ����ķ�ӦΪ����Ŀ�����������ϱ��õ��Ӻ����������ɻ����飬�缫��ӦʽΪC6H6��6H����6e����C6H12��
�ڵ��������������������ӷŵ���������������װ��ͼ��֪����������3.4mol����ת�Ƶ��ӵ����ʵ�����3.4mol��4��13.6mol������ˮ����ɿ�֪����1mol����ʱ����2mol������������3.4mol����ʱͬʱ����6.8mol��������μӷ�Ӧ�ı������ʵ�����xmol����μӷ�Ӧ�����������ʵ�����3xmol��ʣ�౽�����ʵ���Ϊ10mol��25%��xmol������Ӧ�ĺ�����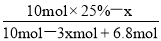 ��100%��10%�����x��
��100%��10%�����x��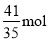 �����Ա�ת��Ϊ������ת�Ƶ��ӵ����ʵ���Ϊ
�����Ա�ת��Ϊ������ת�Ƶ��ӵ����ʵ���Ϊ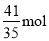 ��6����ô���װ�õĵ���Ч��Ϊ�ǣ�
��6����ô���װ�õĵ���Ч��Ϊ�ǣ� ��
��
���㣺���������Ʊ���������ͼ�ķ�����Ӧ��


 Сѧ���AB��ϵ�д�
Сѧ���AB��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ�����и���һ�»�ѧ�Ծ��������棩 ���ͣ�ѡ����
ijͬѧ���Ľ̲ĵ�֪����ͨп�̵��Ͳ����������Ҫ�ɷ�ΪMnO2��NH4Cl��ZnCl2�����ʡ�����̽���ϸɵ���ڵĺ�ɫ�����������ʱ��������ͼ��ʾʵ�飺�����й�ʵ��������У�����ȷ����

A���������в������������Ǽӿ�����ܽ��ٶ�
B�������ڵIJ��������ǹ���
C����������ʢ��ҩƷ������������
D�������ܵ�Ŀ���dz�ȥ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ�����и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��3�֣������й�ʵ��������У���ȷ����
A������ƿ������ˮϴ���ɲ�������ֱ������������Һ
B���÷�Һ�ķ�������ˮ�;ƾ��Ļ����
C������1L0.1mol/L��NaCl��Һʱ����������ƽ����5.85gNaCl����
D���õιܵμ�Һ��ʱ��Ϊ��ֹҺ�ηɽ����ιܽ����Թ��ڱ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ�����и���1�µ������ۻ�ѧ�Ծ��������棩 ���ͣ������
(14��)�����ᣨH3PO3���Ƕ�Ԫ�ᣬH3PO3��Һ���ڵ���ƽ�⣺H3PO3 H+ + H2PO3����������������NaOH��Һ��Ӧ������Na2HPO3��
H+ + H2PO3����������������NaOH��Һ��Ӧ������Na2HPO3��
��1����д��������������NaOH��Һ��Ӧ�����ӷ���ʽ ��
�ڸ��������ᣨH3PO3�������ʿ��Ʋ�Na2HPO3ϡ��Һ��pH 7���>������<����=������
��ij�¶��£�0.1000 mol��L��1��H3PO3��Һ��c (H+)��2.5��10��2 mol��L��1����OH��֮���������ӵ�Ũ���ɴ�С��˳���� �����¶���H3PO3����ƽ���ƽ�ⳣ��K= ����H3PO3�ڶ���������Բ��ƣ����������λ��Ч���֣�
��2�����������ǿ��ԭ�ԣ���ʹ��ˮ��ɫ���÷�Ӧ�Ļ�ѧ����ʽ ��
��3�����Na2HPO3��ҺҲ�ɵõ������ᣬװ��ʾ��ͼ���£�

˵������Ĥֻ����������ͨ������Ĥֻ����������ͨ����
�������ĵ缫��ӦʽΪ ��
�ڲ�Ʒ������������������ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ�����и���1�µ������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʽΪC9H18O2���л���Q����ϡ�����о�����ת��Ϊһ��������������Ϊͬ���칹�����������A��ͬʱ������һ������B���������������칹,��Q�Ľṹ�����
A��16�� B��8�� C��4�� D��2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ�人�����������Ԫ�µ������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��ѧ�о���ѧϰС��Ե������Һ�����µĹ����ܽᣨ���ڳ����£���������ȷ����
��pH��3��ǿ����Һ1 mL����ˮϡ����100 mL����ҺpH����2����λ
��1 L 0.50 mol��L��1 NH4Cl ��Һ��2 L 0.25 mol��L��1 NH4Cl ��Һ��NH4+ ���ʵ���ǰ�ߴ�
��pH��8.3��NaHCO3��Һ��c(Na+)��c(HCO3��)��c(CO32��)��c(H2CO3)
��pH��4��Ũ�Ⱦ�Ϊ0.1 mol��L��1 ��CH3COOH��CH3COONa�����Һ�У�
c(CH3COO��)��c(CH3COOH)��2��(10��4��10��10) mol/L
A���٢� B���ڢ� C���٢� D���ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ӱ�ʡ����12���¿���ѧ�Ծ��������棩 ���ͣ������
��12�֣�2013���������������Ű�ҹ��ж������������У�����β����ȼúβ������ɿ�����Ⱦ��ԭ��֮һ��
��1��CO2�Ǵ����к�����ߵ�һ���������壬���ƺ�����CO2�ǽ������ЧӦ����Ч;����Ŀǰ����CO2���ϳɶ�������ȡ���˽ϴ�Ľ�չ���仯ѧ��Ӧ�ǣ�
2CO2��g��+6H2��g�� CH3OCH3��g��+3H2O��g�� ��H��0��
CH3OCH3��g��+3H2O��g�� ��H��0��
��д���÷�Ӧ��ƽ�ⳣ������ʽ ��
���жϸ÷�Ӧ��һ�������£�����㶨���ܱ��������Ƿ�ﵽ��ѧƽ��״̬�������� ��
A���������ܶȲ���
B����λʱ��������2molCO2��ͬʱ����1mol������
C��v(CO2)�Uv(H2)=1�U3
D��������ѹǿ���ֲ���
��2������β����������Ҫԭ��Ϊ��2NO(g)+2CO (g)  2CO2 (g) +N2 (g) ���ܱ������з����÷�Ӧʱ��c(CO2)���¶�(T)�������ı����(S)��ʱ��(t)�ı仯���ߣ���ͼ��ʾ��
2CO2 (g) +N2 (g) ���ܱ������з����÷�Ӧʱ��c(CO2)���¶�(T)�������ı����(S)��ʱ��(t)�ı仯���ߣ���ͼ��ʾ��

�ݴ��жϣ�
�ٸ÷�Ӧ�Ħ�H 0��ѡ�����������������
�ڵ��������������һ��ʱ�����������������ѧ��Ӧ���ʡ��������ı����S1��S2������ͼ�л���c(CO2)��T2��S2�����´ﵽƽ������еı仯���ߡ�
��3����֪��CO��g���� 2H2��g�� CH3OH��g����H = -a kJ?mol-1��
CH3OH��g����H = -a kJ?mol-1��
�پ��ⶨ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����£�
�¶ȣ��棩 | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
��ijʱ�̡�250���ø÷�Ӧ�ķ�Ӧ�����������Ũ��Ϊc(CO)=0.4 mol��L��1��c(H2)=0.4 mol��L��1��c(CH3OH)=0.8 mol��L��1, ���ʱv�� v�棨���������������=������
��ij�¶��£�������̶���2L���ܱ������н�1 mol CO��2 mol H2��ϣ���ò�ͬʱ�̵ķ�Ӧǰ��ѹǿ��ϵ���£�
ʱ�䣨min�� | 5 | 10 | 15 | 20 | 25 | 30 |
ѹǿ��(P��/Pǰ) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
�ﵽƽ��ʱCO��ת����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ӱ�ʡ����12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й�˵����ȷ����
A�����ں�������ϸ���һЩͭ�飬����Լ���������ǵĸ�ʴ
B��2NO(g)��2CO(g)=N2(g)��2CO2(g)�ڳ��������Է����У���÷�Ӧ�ġ�H��0
C������0.1mol/LNa2CO3��Һ��CO32����ˮ��̶�����
D�������������Ҵ���������Ӧ����H��0������������Ũ���Ტ���ȣ��÷�Ӧ�ķ�Ӧ���ʺ�ƽ�ⳣ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�걱���и�һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ˮ��Һ�д��������һ��������
A��Ba2+��K+��OH����SO42�� B��Fe3+��NO3����Na+��OH��
C��H+��Na+��Cl����SO42�� D��K+��SO42����HCO3����H+
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com