
分析 (1)双氧水将黄铜矿氧化得到硫酸根和三价铁;
(2)H2O2受热分解;
(3)增大一种反应物的浓度,可提高另一种反应物的转化率;
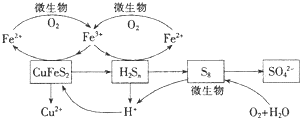
(4)由图知Fe2(SO4)3、H2SO4是中间产物;
(5)铁元素最终全部转化为Fe3+,硫元素转化为硫酸根.
解答 解:(1)①双氧水将黄铜矿氧化得到硫酸根和三价铁,离子方程式为:2CuFeS2+17H2O2+2H+=2Cu2++2Fe3++4SO42-+18H2O,故答案为:2CuFeS2+17H2O2+2H+=2Cu2++2Fe3++4SO42-+18H2O;
②H2O2受热易分解,产物Cu2+、Fe3+催化H2O2分解,故答案为:H2O2受热分解;产物Cu2+、Fe3+催化H2O2分解等;
(2)增大一种反应物的浓度,可提高另一种反应物的转化率,可提高氨水的浓度、提高氧压,故答案为:提高氨水的浓度、提高氧压;
(3)在25℃下,氨水微弱电离,浓度约为0.5a,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(O{H}^{-}).c(N{{H}_{4}}^{+})}{c(N{H}_{3}.{H}_{2}O)}$=$\frac{1{0}^{-7}×0.01}{0.5a}$=$\frac{2×10{\;}^{-9}}{a}$;铵根能与氢氧根结合,促进水的电离,故答案为:正向;
(4)由图知Fe2(SO4)3、H2SO4是中间产物,可循环使用,离子反应方程式为4Fe2++O2+4H+$\frac{\underline{\;微生物\;}}{\;}$4Fe3++2H2O,故答案为:Fe2(SO4)3、H2SO4;4Fe2++O2+4H+$\frac{\underline{\;微生物\;}}{\;}$4Fe3++2H2O;
(5)铁元素最终全部转化为Fe3+,硫元素转化为硫酸根,当有2mol SO42-生成时,失去电子工17mol,消耗O2的物质的量为$\frac{17}{4}$=4.25mol,故答案为:4.25 mol.
点评 本题考查物质的分离提纯、电离常数的计算以及氧化还原反应的计算等知识,侧重考查基本理论及计算能力,题目难度中等.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题

| A. | 正极通入H2,发生还原反应 | |
| B. | 负极通入H2,发生还原反应 | |
| C. | 总反应式为2H2+O2=2H2O | |
| D. | 导电离子为质子,且在电池内部由正极定向移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ③⑥ | C. | ③ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
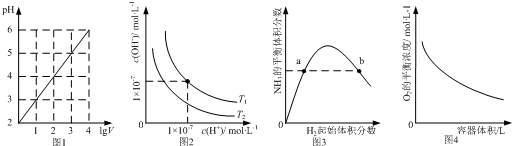
| A. | 图1表示1 LpH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化 | |
| B. | 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1 | |
| C. | 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点 | |
| D. | 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)?2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com